ΠΑΝΕΠΙΣΤΗΜΙΟ ΚΡΗΤΗΣ
ΤΜΗΜΑ ΧΗΜΕΙΑΣ
ΕΡΓΑΣΤΗΡΙΟ ΦΩΤΟΧΗΜΕΙΑΣ ΚΑΙ ΧΗΜΙΚΗΣ ΚΙΝΗΤΙΚΗΣ
Πάνος Παπαγιαννακόπουλος
Γιάννης Γ. Λαζάρου
Φασματοσκοπία Μάζας
Η φασματομετρία μάζας είναι μία ευαίσθητη τεχνική για τον ποιοτικό και ποσοτικό προσδιορισμό χημικών ενώσεων. Βασίζεται στον διαχωρισμό των μαζών φορτισμένων σωματιδίων (κυρίως κατιόντων) με την βοήθεια κατάλληλης διάταξης (μαγνητική, τετραπόλου, χρόνου πτήσης) και την εύρεση της αντιστοιχίας των μαζών των λαμβανομένων ιόντων με την δομή της πρόδρομης ένωσης. Η αντιστοιχία αυτή προϋποθέτει την γνώση των διαδικασιών ιονισμού και επιπλέον του μηχανισμού της πιθανής θραυσματοποίησης των ιόντων.
Ο ιονισμός των μορίων γίνεται με διάφορες τεχνικές, με συνηθέστερες τις α) ηλεκτρονιακή πρόσκρουση (
Electron impact ionization, EI) με ταχέως κινούμενα ηλεκτρόνια σε ηλεκτρικό πεδίο, β) φωτοϊονισμός (Photoionization, PI), με την βοήθεια φωτός στην υπεριώδη περιοχή του ηλεκτρομαγνητικού φάσματος και γ) χημικός ιονισμός (Chemical ionization, CI), μέσω κρούσεως με άλλα ιόντα. Ο προσδιορισμός της μοριακής μάζας διευκολύνεται από της λήψη του κατιόντος της χημικής ένωσης (μητρικό ιόν), που προϋποθέτει την επιβιωσιμότητα του συγκεκριμένου κατιόντος. Επιπλέον, σε περιπτώσεις ανάλυσης χημικών ενώσεων με ίδιο μοριακό βάρος ή ισομερών, η θραυσματοποίηση του αρχικού μητρικού ιόντος σε ιόντα μικρότερης μάζας, δίνει πληροφορίες για την δομή των χημικών ενώσεων.Η θραυσματοποίηση (
fragmentation) του μητρικού ιόντος είναι αναπόφευκτη για την πληθώρα των χημικών ενώσεων που ιονίζονται με την απλούστερη και συχνότερα απαντούμενη τεχνική της πρόσκρουσης ηλεκτρονίων με κινητική ενέργεια στην περιοχή 40 – 70 eV. Οι ενέργειες ιονισμού των χημικών ενώσεων είναι συνήθως μικρότερες από 15 eV και εξαρτώνται από την δομή της χημικής ένωσης. Σαν επακόλουθο, το μητρικό ιόν βρίσκεται διεγερμένο έχοντας ένα μεγάλο ποσοστό της αρχικής κινητικής ενέργειας των ηλεκτρονίων (>25 eV) και ακολουθεί πορείες μονομοριακής διάσπασης σε μικρότερα σωματίδια (θραύσματα), και αυτά με την σειρά τους σε άλλα μικρότερα, μέχρι είτε ιονισμένα άτομα, ή ιδιαίτερα σταθερά θετικά ιόντα. Οι πορείες διάσπασης εξαρτώνται από την χημική δομή κάθε ιόντος και μπορούν να είναι είτε α) ισομερείωση ιόντος ή β) διάσπαση ιόντος σε άλλο μικρότερο ιόν και ουδέτερο σωματίδιο. Οι παράμετροι που καθορίζουν την συνεισφορά κάθε πορείας είναι: α) σταθερότητα προδρόμου ιόντος και προϊόντων (ισομερές ή θραύσματα) β) αντίστοιχο ενεργειακό φράγμα της θραύσης του ιόντος και γ) εσωτερική ενέργεια του προδρόμου ιόντος.Η άμεση πρόβλεψη όλων των διαδικασιών θραυσματοποίησης ενός ιόντος δεν είναι απλή, ιδιαίτερα αν το ποσοστό θραυσματοποίησης σε κάθε πορεία είναι το κυρίως ζητούμενο. Μία απλή ποιοτική πρόβλεψη των κυριοτέρων πορειών είναι δυνατόν να επιτευχθεί με γνώμονα την χημική δομή του ιόντος καθώς και των προϊόντων θραυσματοποίησης χρησιμοποιώντας επιχειρήματα γενικής και οργανικής χημείας.
Η σταθερότητα ενός θετικά φορτισμένου ιόντος εξαρτάται από την ευκολία εξάπλωσης του φορτίου σε περισσότερα από ένα άτομα του μορίου (αποεντόπιση φορτίου, π.χ. σταθερότητα κατιόντων σε συζυγιακά ή αρωματικά συστήματα) και την ύπαρξη ομάδων που ευνοούν ή απωθούν το θετικό φορτίο (π.χ. άτομα
F απωθούν το θετικό φορτίο λόγω έντονης ηλεκτραρνητικότητας, ενώ άτομα N, Ο ευνοούν την ύπαρξη θετικού φορτίου λόγω των ζευγών ηλεκτρονίων που διαθέτουν σε αρκετά υψηλές ενεργειακές στάθμες – μακρυά από τους πυρήνες, εύκολα ιονιζόμενα). Σε περιπτώσεις ύπαρξης θετικού φορτίου σε άτομο που συνδέεται με άλλες ομάδες, η ευκολία αποεντοπισμού του θετικού φορτίου στις ομάδες μέσω υπερσυζυγιακού φαινομένου (π.χ. σταθερότητες καρβοκατιόντων (CH3)3C+ > (CH3)2CH+ > CH3CH2+) είναι σταθεροποιός παράγοντας του κατιόντος και οδηγεί είτε σε εκλεκτική διάσπαση δίνοντας το σταθερότερο κατιόν ή οδηγεί σε ισομερίωση σε σταθερότερο κατιόν. Η διάσπαση ενός κατιόντος με παραγωγή μικρού σταθερού ουδετέρου μορίου (π.χ. H2O, CO2, CO, HCN) ευνοείται λόγω συνολικής μείωσης της ενέργειας του συστήματος με την αποβολή του σταθερού μορίου. Οι μηχανισμοί της διάσπασης για τα συνηθέστερα είδη μορίων θα συζητηθούν λεπτομερέστερα στη συνέχεια.
2. ΟΡΓΑΝΟΛΟΓΙΑ
Ο φασματογράφος μάζας αποτελείται από τα ακόλουθα βασικά τμήματα: α) περιοχή ιονισμού β) φίλτρο μαζών και γ) ανιχνευτής ιόντων. Η περιοχή ιονισμού είναι ο χώρος στον οποίο ένα μέρος του δείγματος (στις περισσότερες τεχνικές ιονισμού απαιτείται να βρίσκεται στην αέρια φάση) ιονίζεται και τα παραγόμενα ιόντα οδηγούνται στο φίλτρο μαζών. Ο σκοπός του φίλτρου μαζών είναι ο διαχωρισμός των ιόντων σύμφωνα με την μοριακή τους μάζα και την επιλογή των ιόντων με μάζα σε συγκεκριμένη περιοχή (με εύρος συνήθως 1
amu, διακριτική ικανότητα 1 amu) τα οποία συνεχίζουν την πορεία τους στον ανιχνευτή ιόντων. Ο ανιχνευτής συλλαμβάνει τα προσπίπτοντα ιόντα, ενισχύει το λαμβανόμενο ασθενές σήμα και το οδηγεί στην κεντρική συσκευή ελέγχου και μέτρησης. Η φασματογραφία μάζας αποτελεί μία ποσοτική αναλυτική τεχνική με μία συνεχώς ανανεούμενη ποικιλία μεθόδων ιονισμού, διαχωρισμού μαζών και ανίχνευσης ιόντων.
2α. Μέθοδοι ιονισμού
Η συνηθέστερα χρησιμοποιούμενη μέθοδος ιονισμού στην αέρια φάση είναι του ηλεκτρονιακού ιονισμού (
Electron Ionization, Electron impact ionization, E.I.), με πλεονεκτήματα την καλή κατανόηση του μηχανισμού της, την καθολικότητα της εφαρμογής της σε όλες τις πτητικές χημικές ενώσεις και την αναπαραγωγισιμότητα των λαμβανομένων φασμάτων μάζας. Η μέθοδος βασίζεται στον ιονισμό ενός μορίου S που προκαλείται από την σύγκρουση του με ταχέως κινούμενα ηλεκτρόνια:Η παραγωγή των ηλεκτρονίων επιτυγχάνεται σε ένα πυρακτωμένο νήμα βολφραμίου
W ή ρηνίου Re, που αποτελεί την κάθοδο, και η επιτάχυνση τους επιτυγχάνεται με την βοήθεια ηλεκτρικού πεδίου, δυναμικού από 10 έως 250 V. Συνεπώς κάθε ηλεκτρόνιο αποκτά κινητική ενέργεια Εkin = qe V, όπου qe είναι το φορτίο του ηλεκτρονίου και V η εφαρμοζόμενη διαφορά δυναμικού. Συνήθως, το εφαρμοζόμενο V είναι 70 V, με αποτέλεσμα κάθε ηλεκτρόνιο να έχει κινητική ενέργεια 70 eV (αποτελεί την πρότυπη κινητική ενέργεια ηλεκτρονίων που χρησιμοποιείται για την αρχειοθέτηση των φασμάτων μάζας σε κατάλληλους καταλόγους). Η πρόσκρουση του ηλεκτρονίου με κινητική ενέργεια Ekin μερικές δεκάδες eV είναι περισσότερο από αρκετή για τον ιονισμό του S, θεωρώντας ότι για τον απλό ιονισμό ενός ατόμου ή μορίου S χρειάζονται περίπου 5 – 25 eV. Στον Πίνακα 2.1 δίνονται (σε eV) τα δυναμικά πρώτου ιονισμού (S -> S+) για τα συνηθέστερα άτομα και μόρια (ή ελεύθερες ρίζες). Συνεπώς, το παραγόμενο κατιόν S+ σχηματίζεται διεγερμένο και ακολουθεί πορείες μονομοριακής διάσπασης προς απλούστερα θραύσματα S1+, S2+, …:ή ακόμη και δευτερογενής θραυσματοποίηση των πρωτογενών θραυσμάτων.
Το ανωτέρω σχήμα θραυσματοποίησης είναι κατανοητό θεωρώντας ότι η ενέργεια που απαιτείται για την θραύση ενός δεσμού (ή την αποχώρηση μιάς ουδέτερης ομάδας) βρίσκεται στην περιοχή 120 – 500 kJ/mol, με δεδομένη την σχέση 1
eV/σωματίδιο = 96.486 kJ/mol, και ότι το παραγόμενο κατιόν συνήθως είναι διεγερμένο κατά μερικά eV. Στον Πίνακα 2.2 παρατίθενται ενδεικτικά τυπικές ενέργειες διάσπασης δεσμών (σε kJ/mol) για τα συνηθέστερα ουδέτερα μόρια (δεν αναμένεται να διαφέρουν αρκετά από τις αντίστοιχες των κατιόντων). Οι πορείες θραυσματοποίησης εξαρτώνται από την μοριακή δομή του S και των παραγομένων κατιόντων, με αποτέλεσμα την ικανότητα προσδιορισμού της δομής του S με εξέταση του φάσματος μάζας. Είναι ακόμη δυνατή η ταυτοποίηση ισομερών με γνώμονα τις πιθανές διαφορές στις πορείες διάσπασης τους, και δεν είναι υπερβολικό να λεχθεί ότι η διασάφηση του μηχανισμού διάσπασης κατά τον ηλεκτρονιακό ιονισμό απαιτεί "χημική διαίσθηση" και η ανάλυση του φάσματος μάζας καθίσταται ευκολότερη χρησιμοποιώντας χημικά επιχειρήματα.Πίνακας 2.1
. Τυπικές ενέργειες πρώτου ιονισμού (σε eV) ατόμων και μορίων.|
H |
13.598 |
N2 |
15.576 |
|
He |
24.587 |
NH3 |
10.2 |
|
C |
11.260 |
Cº N |
14.3 |
|
N |
14.534 |
HCº N |
13.8 |
|
O |
13.618 |
NO |
9.25 |
|
F |
17.422 |
NO2 |
9.79 |
|
Si |
8.151 |
O2 |
12.063 |
|
S |
10.360 |
OH |
13.17 |
|
Cl |
12.967 |
H2O |
12.6 |
|
Br |
11.814 |
CH3OH |
10.84 |
|
I |
10.451 |
CH3CH2OH |
10.49 |
|
H2 |
15.427 |
CO |
14.013 |
|
CH2 |
10.396 |
CO2 |
13.769 |
|
CH3 |
9.83 |
F2 |
15.7 |
|
CH4 |
12.6 |
HF |
15.77 |
|
HCº CH |
11.4 |
H2S |
10.4 |
|
H2C=CH2 |
10.5 |
CH3SH |
9.448 |
|
CH3CH2 |
8.4 |
Cl2 |
11.48 |
|
CH3CH2 |
11.5 |
HCl |
12.74 |
|
CH3CH2CH3 |
11.1 |
Br2 |
10.54 |
|
C6H6 |
9.24 |
HBr |
11.62 |
|
C6H5CH3 |
8.82 |
I2 |
9.28 |
Πίνακας
2.2. Τυπικές ενέργειες διάσπασης δεσμών μορίων (σε kJ mol-1).|
H-H |
435.56 |
H2C=CH2 |
720.32 |
|
H3C-H |
439.32 |
HCº CH |
961.52 |
|
H3C-CH3 |
358.64 |
O=O |
498.35 |
|
H3C-OH |
385.81 |
HO-H |
498.81 |
|
H3CO-H |
436.39 |
Nº N |
945.37 |
|
H3C-F |
459.38 |
F-F |
158.78 |
|
H3C-Cl |
353.63 |
H-F |
569.94 |
|
H3C-Br |
296.36 |
Cl-Cl |
242.60 |
|
H3C-I |
239.10 |
H-Cl |
431.61 |
|
H3C-NH2 |
343.60 |
Br-Br |
192.81 |
|
H3C-SH |
309.30 |
I-I |
151.10 |
Τα σοβαρότερα μειονεκτήματα της μεθόδου του ηλεκτρονιακού ιονισμού είναι η απαιτούμενη πτητικότητα της χημικής ένωσης (ή μίγματος ενώσεων) και η εκτενής μοριακή θραυσματοποίηση που συνοδεύει τον ιονισμό. Συχνά, παρατηρείται ακόμη και η έλλειψη της μητρικής κορυφής (που αντιστοιχεί στην μοριακή μάζα της χημικής ένωσης) και η σχετική αδυναμία προσδιορισμού του μοριακού βάρους της ένωσης. Ομως, το δεύτερο μειονέκτημα δεν είναι εξαιρετικά σοβαρό και η θραυσματοποίηση οδηγεί σε ένα πλήθος ιόντων με χαρακτηριστικές θέσεις και εντάσεις στο φάσμα μάζας που αποτελεί το "δακτυλικό αποτύπωμα" της χημικής ένωσης. Το φάσμα μάζας είναι δυνατόν να χρησιμοποιηθεί από προγράμματα υπολογιστών με την βοήθεια "βιβλιοθηκών αναφοράς" για την ταυτοποίηση της χημικής ενώσεως ή των χημικών ενώσεων που απαρτίζουν ένα μίγμα. Οταν η θραυσματοποίηση δεν είναι επιθυμητή, δύο εναλλακτικοί μέθοδοι ιονισμού μορίων στην αέρια φάση είναι ο χημικός ιονισμός (
Chemical Ionization, C.I.) και ο φωτοϊονισμός (Photoionization, P.I.). Στον χημικό ιονισμό χρησιμοποιούνται αντιδράσεις μεταξύ ιόντων και μορίων για την παραγωγή ιόντων, χρησιμοποιώντας ένα αέριο (με γενικό τύπο RH), όπως μεθάνιο CH4, ισοβουτάνιο (CH3)3CH ή αμμωνία NH3 το οποίο ιονίζεται με ηλεκτρονιακό ιονισμό προς RH+. Μεγάλοι χρόνοι παραμονής ή υψηλή πίεση του αερίου συντελούν σε αντιδράσεις μεταφοράς φορτίου (ή ακόμη και ατόμων και ομάδων) μεταξύ του κατιόντος RH+ και των συστατικών υπό ανάλυση S, δημιουργώντας ιόντα S+:
Το πλεονέκτημα της μεθόδου σε σχέση με τον ηλεκτρονιακό ιονισμό είναι η χαμηλή ενέργεια η οποία εναποτίθεται στο παραγόμενο κατιόν
S+ με αποτέλεσμα το μικρό ποσοστό θραυσματοποίησης του και την παρουσία (συνήθως) της μητρικής κορυφής του S με την επακόλουθη ευκολία προσδιορισμού του μοριακού βάρους του S. Τα λαμβανόμενα φάσματα μάζας είναι εξαιρετικά απλά, όμως περιέχουν πολύ μικρό ποσοστό πληροφορίας (εκτός της μοριακής μάζας του S) και δυστυχώς δεν είναι πάντα αναπαραγωγίσιμα, καθ' όσον εξαρτώνται πολύ από τις συνθήκες ιονισμού, το είδος του αερίου RH, την πίεση και τον χρόνο παραμονής του δείγματος στην περιοχή ιονισμού και την φύση του δείγματος. Η δημιουργία κατιόντων SH+, με μοριακή μάζα μεγαλύτερη από του S είναι ένα κοινό χαρακτηριστικό της μεθόδου του χημικού ιονισμού, ακόμη και σε περιπτώσεις όπου ο ηλεκτρονιακός ιονισμός δεν δίνει μητρικό ιόν S+.Η μέθοδος του φωτοϊονισμού χρησιμοποιεί πηγή φωτός (συνήθως υπεριώδες, λ < 350
nm) για τον ιονισμό του S, με την βοήθεια laser ή λυχνίας Hg ή Xe. Με δεδομένες τις σχέσεις E = hv = hc/λ μετά από αριθμητική αντικατάσταση προκύπτει η ισοδυναμία E(eV) = 1239.86 / λ (nm) και E(kJ/mol) = 1.196 x 105 / λ (nm). Συνεπώς, ένα μήκος κύματος μονοχρωματικού φωτός λ = 248 nm ισοδυναμεί με ενέργεια φωτονίων 5 eV και γιά μήκη κύματος λ < 200 nm (vacuum UV) η ενέργεια των φωτονίων είναι Εφ > 6 eV. Η ενέργεια των φωτονίων είναι μόλις αρκετή για τον ιονισμό μορίων και ελευθέρων ριζών με χαμηλά δυναμικά ιονισμού:Η μέθοδος του φωτοϊονισμού δεν χρησιμοποιείται για την ανάλυση των κοινών μορίων και αποτελεί μία μέθοδο ιονισμού σε ερευνητικό επίπεδο για την ανάλυση και ανίχνευση ασταθών ελευθέρων ριζών που παράγονται σε χημικές αντιδράσεις, οι οποίες θα θρυμματιζόταν εντελώς κατά τον ηλεκτρονιακό ιονισμό. Μάλιστα, με κατάλληλη επιλογή του μήκους κύματος της ιονίζουσας ακτινοβολίας είναι δυνατή η εκλεκτική ανίχνευση ορισμένων μορίων ή ελευθέρων ριζών.
2α. Μέθοδοι διαχωρισμού μαζών
1) Μαγνητικό πεδίο. Ο διαχωρισμός μαζών είναι το κρισιμότερο στάδιο στην πορεία μιας ανάλυσης και έχουν αναπτυχθεί μέθοδοι διαχωρισμού που διαφέρουν ως προς τα χαρακτηριστικά τους, τις δυνατότητες και τους περιορισμούς τους. Γενικά, δεν φαίνεται να υπάρχει μία μέθοδος διαχωρισμού μαζών που να είναι εξ' ίσου αποτελεσματική σε όλες τις εφαρμογές της ανάλυσης με φασματογραφία μάζας. Οι συνηθέστερες μέθοδοι διαχωρισμού μαζών (φίλτρα μαζών) είναι α) μαγνητικού πεδίου β) τετραπόλου και γ) χρόνου πτήσης. Ολα τα φίλτρα μαζών βασίζονται στην εφαρμογή ηλεκτρικών και μαγνητικών πεδίων που επιδρούν στην κίνηση φορτισμένων σωματιδίων (ιόντων). Οι μαθηματικές σχέσεις που διέπουν την αλληλεπίδραση των ηλεκτρικών και μαγνητικών πεδίων με τα ιόντα έχουν διατυπωθεί από τον Νεύτωνα (δεύτερος νόμος) και τον νόμο της δύναμης του Lorentz, αντίστοιχα:
F = m
γ (1)
F = z( E + (v ´ B) ) (2)
όπου F είναι η το διάνυσμα της δύναμης που ασκείται στο ιόν, m η μάζα του, γ το διάνυσμα της επιτάχυνσης, z το φορτίο του ιόντος, E το διάνυσμα της έντασης του ηλεκτρικού πεδίου, v το διάνυσμα της ταχύτητας του ιόντος και Β το διάνυσμα της έντασης του μαγνητικού πεδίου. Από την σχέση (1) φαίνεται ότι η δύναμη F προκαλεί επιτάχυνση ανάλογη της μάζας του σωματιδίου, ενώ από την σχέση (2) φαίνεται ότι η εφαρμοζόμενη δύναμη F είναι ανάλογη του ιοντικού φορτίου z. Συνεπώς, και οι τρείς προαναφερόμενες μέθοδοι διαχωρίζουν τα ιόντα ανάλογα με τον λόγο m/z, όπου m είναι η μοριακή μάζα του ιόντος και z το φορτίο του. Στην πλειονότητα των περιπτώσεων τα παραγόμενα ιόντα είναι απλά φορτισμένα (z=1) και οι εξαιρέσεις (z > 1) πρέπει να αναζητηθούν σε μόρια με πολύ χαμηλά δυναμικά ιονισμού (π.χ. θειούχες ενώσεις ή χημικές ενώσεις βαρέων στοιχείων). Παρ' όλα αυτά, η δημιουργία ιόντων με φορτίο z > 1 δεν συμβαίνει σε μεγάλο βαθμό και οι εντάσεις τους σε ένα φάσμα μάζας είναι μικρές.
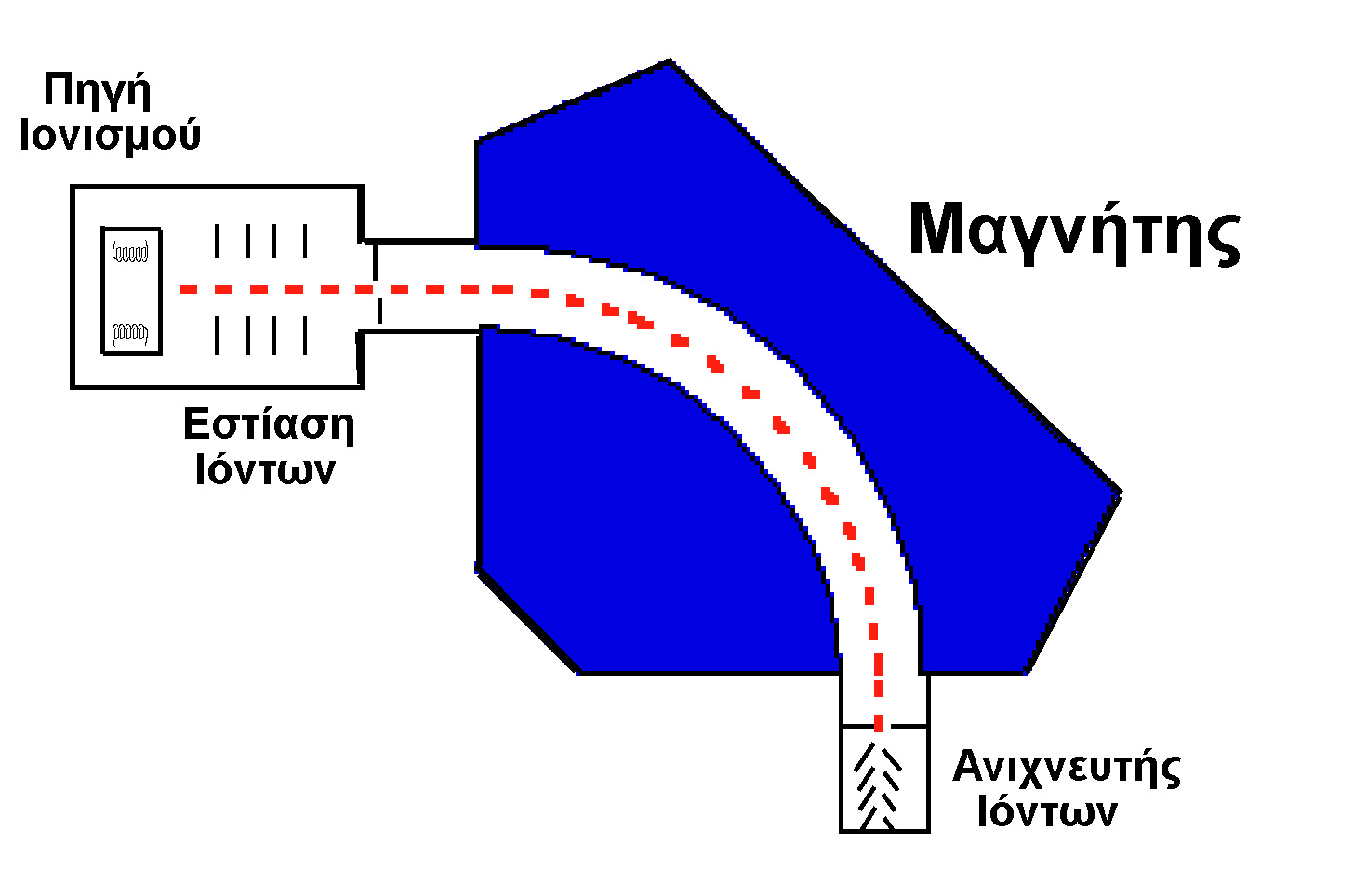
Η μέθοδος του μαγνητικού πεδίου (
magnetic sector mass filter) είναι η αρχαιότερη και ταυτόχρονα η περισσότερο ακριβής και δαπανηρή, ενώ μία απλή διάταξη του παρουσιάζεται στο επόμενο σχήμα.
Τα ιόντα μετά την δημιουργία τους εστιάζονται κατάλληλα με "φακούς ιόντων" (ανομοιογενή ηλεκτρικά πεδία που συγκλίνουν τις τροχιές των ιόντων) με σκοπό την αύξηση της ευαισθησίας της μεθόδου και οδηγούνται σε ένα χώρο όπου μαγνητικό πεδίο έντασης Β εφαρμόζεται κάθετα στην κατεύθυνση κίνησης των ιόντων. Τα ιόντα εισέρχονται στο μαγνητικό πεδίο έχοντας ευθύγραμμη ομαλή πορεία με ταχύτητα
v, και αναγκάζονται να ακολουθήσουν κυκλική τροχιά, της οποίας η ακτίνα εξαρτάται από τον λόγο m/z. Η κινητική ενέργεια ενός ιόντος πρίν εισέλθει στο μαγνητικό πεδίο είναι
![]()
ενώ η ταχύτητα
v δίνεται από:![]()
όπου
Va το εφαρμοζόμενο δυναμικό επιτάχυνσης των ιόντων. Από τον νόμο της δύναμης του Lorentz, το μαγνητικό πεδίο εφαρμόζει μία δύναμη zvB η οποία ισούται με την φυγόκεντρο δύναμη mv2/r, καθώς το ιόν κινείται σε κυκλική τροχιά, με ακτίνα r:![]()
Αντικατάσταση με την τιμή
v της ταχύτητας, προκύπτει τελικά:![]()
Συνεπώς, αν ο ανιχνευτής βρίσκεται σε συγκεκριμένη θέση που αντιστοιχεί σε μία τροχιά με ακτίνα
r, μόνο τα ιόντα με συγκεκριμένο λόγο m/z, ο οποίος ικανοποιεί την ανωτέρω ισότητα φθάνουν στον ανιχνευτή. Η σάρωση σε όλες τις επιθυμητές μάζες (ή ακριβέστερα τον λόγο m/z) γίνεται είτε μεταβάλλοντας την ένταση του μαγνητικού πεδίου Β ή μεταβάλλοντας το αρχικό δυναμικό Va επιτάχυνσης των ιόντων. Ο δεύτερος τρόπος έχει το πλεονέκτημα της έλλειψης υστέρησης της μεταβολής του μαγνητικού πεδίου, όμως η ευαισθησία είναι σχετικά ανάλογη του λόγου m/z. Η αναπόφευκτη θερμική κίνηση των ιόντων προκαλεί μία μείωση της θεωρητικά άπειρης διακριτικής ικανότητας, η οποία μπορεί να βελτιωθεί σημαντικά με την χρήση σχισμών (slits) οι οποίες τοποθετούνται πριν την είσοδο στο μαγνητικό πεδίο και περιορίζουν την είσοδο σε ιόντα που κινούνται σε συγκεκριμένη κατεύθυνση. Η αύξηση της διακριτικής ικανότητας συντελεί στη δυνατότητα διαχωρισμού ιόντων με διαφορές μάζας της τάξεως των 0.01 amu. Γιά παράδειγμα, ο διαχωρισμός των CO, N2, H2C=CH2 και της ελεύθερης ρίζας H2C=N με μοριακές μάζες 27.9949, 28.0062, 28.0312 και 28.0187, αντίστοιχα, είναι εφικτός. Επιπλέον, η μαγνητική μέθοδος διαχωρισμού μαζών χαρακτηρίζεται από εξαιρετικά καλή ευαισθησία, αναπαραγωγίσιμα φάσματα μάζας, υψηλή δυναμική περιοχή (μεγάλη κλίμακα μαζών) και μπορεί να εφαρμοστεί σε ποσοτικές εφαρμογές. Το σημαντικότερο μειονέκτημα της μεθόδου είναι το υψηλότατο κόστος.2) Τετραπολικό φίλτρο μαζών (quadrupole mass filter). Αποτελεί μία από τις νεώτερες μεθόδους διαχωρισμού μαζών, οικονομικότερη από την χρήση του μαγνητικού φίλτρου μαζών με αποτέλεσμα την σημαντικά ευρύτερη χρήση της. Ο διαχωρισμός μαζών επιτυγχάνεται με την υπέρθεση ενός εναλλασομένου ηλεκτρικού πεδίου έχοντας συχνότητα στην περιοχή των ραδιοκυμάτων (RF, radiofrequency) σε ένα συνεχές (DC) ηλεκτρικό πεδίο. Το DC-RF πεδίο εφαρμόζεται σε τέσσερις παράλληλες ράβδους, όπως δείχνεται στο επόμενο σχήμα.
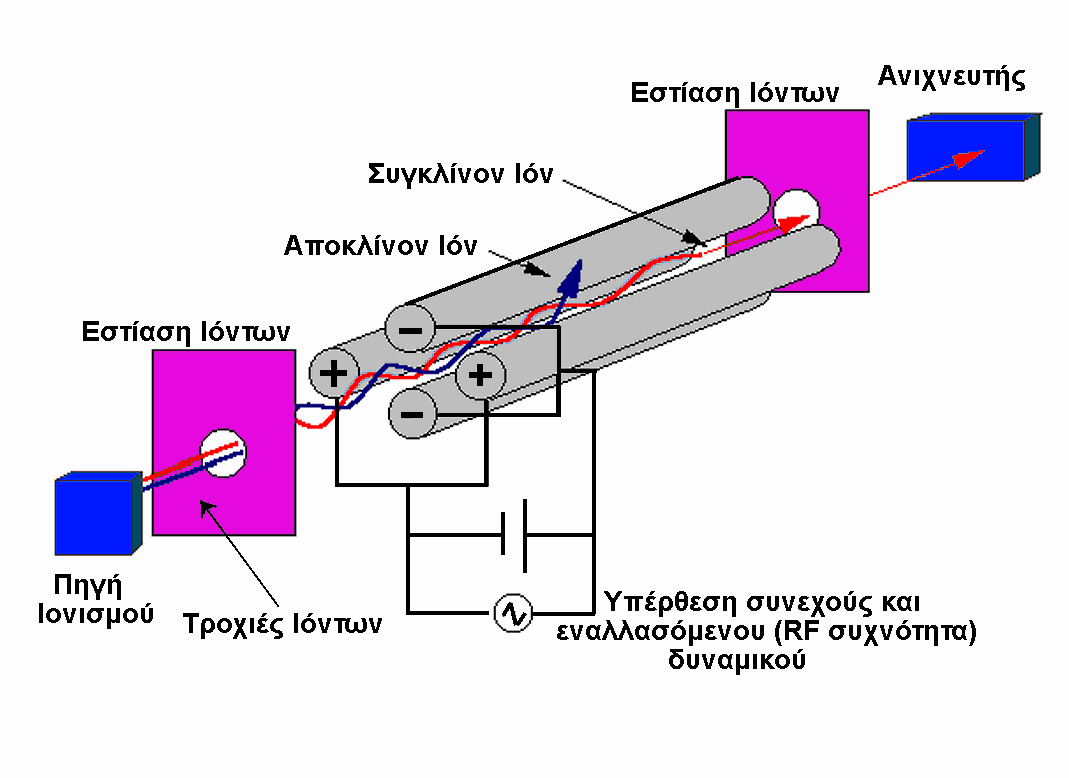
Σε κάθε ζεύγος αντιθέτως ευρισκομένων ράβδων το ηλεκτρικό πεδίο περιγράφεται με την σχέση:
W = 2[U + Vcos(
ωt)]όπου
U το δυναμικό του συνεχούς πεδίου, V το μέγιστο του δυναμικού του εναλλασσομένου πεδίου, ω η κυκλική συχνότητα του πεδίου RF και t ο χρόνος. Τα ιόντα που κατευθύνονται στην κατεύθυνση του Ζ άξονα (ορίζεται ως παράλληλος με τις ράβδους) αναγκάζονται να κινηθούν σε μία τροχιά ταλάντωσης ανάμεσα στους άξονες Χ και Υ. Η μαθηματική ανάλυση της κίνησης ενός ιόντος στο συνδυασμό των πεδίων είναι αρκετά πολύπλοκη, και έχει επιτευχθεί χρησιμοποιώντας κλασσική μηχανική (εξισώσεις Matthieu). Η περιγραφή της κίνησης του ιόντος μπορεί να γίνει με την εισαγωγή των παραμέτρων:![]()
και
![]()
Οι υπολογισμοί δείχνουν οτι μόνο οι παράμετροι α και
q αρκούν για τον προσδιορισμό της τροχιάς του ιόντος. Όταν το πλάτος της ταλάντωσης του ιόντος παραμένει σταθερό στο χρόνο η τροχιά χαρακτηρίζεται ως σταθερή, ενώ αν το πλάτος της ταλάντωσης αυξάνει με την πάροδο του χρόνου, τότε η τροχιά χαρακτηρίζεται ως ασταθής. Όπως είναι προφανές, μία σταθερή τροχιά έχει σαν αποτέλεσμα την δίοδο ενός ιόντος διαμέσου του χώρου καθ' όλο το μήκος των ράβδων, ενώ αντίθετα, αν η τροχιά είναι ασταθής, το ιόν τελικά προσκρούει πάνω στις ράβδους, εξουδετερώνεται και δεν κατορθώνει να φτάσει στον ανιχνευτή (που βρίσκεται στο άλλο άκρο των ράβδων). Η ανάλυση της τροχιάς ενός ιόντος φαίνεται στο ακόλουθο διάγραμμα σταθερότητας α = f(q) .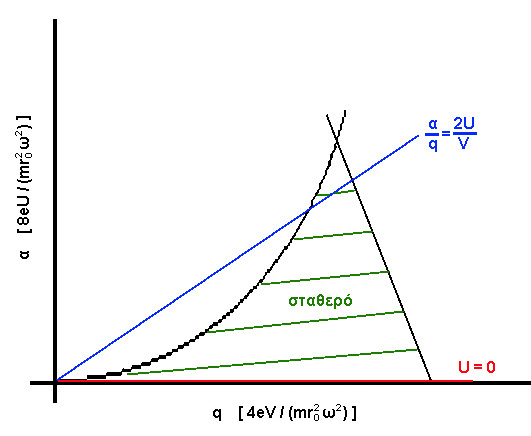
Μόνο τα ιόντα με τιμές α και
q στην (σχεδόν) τριγωνική γραμμοσκιασμένη περιοχή εκτελούν σταθερές ταλαντώσεις. Γιά ένα δεδομένο λόγο 2U/V, ο λόγος α/q είναι ο ίδιος γιά όλες τις μάζες και τα σημεία λειτουργίας γιά όλες τις μάζες βρίσκονται σε μία ευθεία γραμμή στο διάγραμμα σταθερότητας, η οποία διέρχεται από την αρχή των αξόνων. Το διάγραμμα σταθερότητας και οι εκφράσεις των παραμέτρων α και q δείχνουν ότι:α) η μάζα
m είναι ανάλογη του V (με την ω σταθερή).β) η διακριτική ικανότητα Δ
m/m είναι σταθερή για σταθερό λόγο U/V και επίσης δεν μεταβάλλεται με την μάζα m.γ) η διακριτική ικανότητα μπορεί να ρυθμιστεί με την μεταβολή του
U.δ) οι παράμετροι α και
q εξαρτώνται από το λόγο m/z.Αξίζει να παρατηρηθεί ότι αν το εναλλασσόμενο πεδίο μηδενιστεί τότε όλα τα σημεία βρίσκονται στον
q-άξονα και για ένα πολύ ασθενές εναλλασσόμενο πεδίο όλα τα ιόντα εκτελούν σταθερές ταλαντώσεις. Επιπλέον, λόγω της θερμικής κίνησης των ιόντων, η ανεξαρτησία της διακριτικής ικανότητας από την μάζα ισχύει μόνο για επαρκή χρόνο παραμονής στο τετραπολικό πεδίο και αρκετά στενή κατανομή ταχυτήτων στον άξονα Ζ. Η διαπερατότητα των ιόντων δια μέσου του τετραπολικού φίλτρου μειώνεται με την αύξηση της διακριτικής ικανότητας (αύξηση του U) καθ' όσον τα σημεία λειτουργίας ανέρχονται στο διάγραμμα σταθερότητας. Η σάρωση της κλίμακας μαζών συνήθως γίνεται είτε με μεταβολή της κυκλικής συχνότητας ω, ή με παράλληλη μεταβολή των εντάσεων των πεδίων U και V, κρατώντας τον λόγο U/V σταθερό.Τα πλεονεκτήματα του τετραπολικού φίλτρου μαζών είναι το μικρό κόστος και η αναπαραγωγισιμότητα των λαμβανομένων φασμάτων μάζας. Μειονεκτήματα του είναι η χαμηλή διακριτική ικανότητα (1
amu) και η εξάρτηση της διαπερατότητας ενός ιόντος από την μάζα του. Οι τετραπολικοί φασματογράφοι μάζας χρησιμοποιούνται ευρέως στην καθημερινή χημική ανάλυση και συνήθως ακολουθούν τους αέριους χρωματογράφους (Gas Chromatography, GC) οι οποίοι επιτυγχάνουν τον διαχωρισμό των συστατικών ενός μίγματος για την ευκολότερη ταυτοποίηση κάθε συστατικού.3) Χρόνος πτήσης ιόντων (Time-of-flight). Η τεχνική του χρόνου πτήσης χρησιμοποιεί την εξάρτηση της ταχύτητας από την μάζα ενός ιόντος που κινείται σε χώρο απαλλαγμένο ηλεκτρομαγνητικών πεδίων.
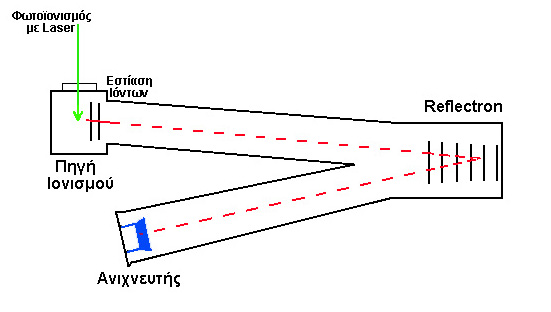
Το σχηματιζόμενο ιόν επιταχύνεται σε ταχύτητα ν κάτω από την επίδραση ηλεκτρικού πεδίου δυναμικού
V:![]()
![]()
Μετά την αρχική επιτάχυνση, το ιόν εισέρχεται σε χώρο απουσία ηλεκτρικού πεδίου στον οποίο κινείται ευθύγραμμα και ομαλά μέχρι τον ανιχνευτή, σε απόσταση
L, απαιτώντας χρονικό διάστημα t:![]()
Συνεπώς, ο απαιτούμενος χρόνος εξαρτάται από την μάζα του ιόντος και ως εκ τούτου επιτυγχάνεται η διάκριση των ιόντων ανάλογα της μάζας τους. Η τεχνική προαπαιτεί τον ακριβή καθορισμό του χρόνου εκκίνησης του ιόντος από την πηγή ιονισμού. Είναι προφανές ότι η δημιουργία ιόντων και η τελική ανίχνευση τους δεν είναι δυνατόν να πραγματοποιείται με συνεχή τρόπο, αλλά μόνο με την μορφή παλμών. Ως εκ τούτου, η τεχνική συνιστάται στην χημική ανάλυση διαδικασιών που εκτελούνται παλμικά (φωτοδιάσπαση και απόξεση επιφανειών, με παλμικό
laser).
2γ. Μέθοδοι ανίχνευσης ιόντων
Οι μέθοδοι ανίχνευσης ιόντων στηρίζονται στο γεγονός της δευτερογενούς εκπομπής ηλεκτρονίων κατά την πρόσπτωση ηλεκτρονίων ή ιόντων σε επιφάνεια, κατάλληλα επιστρωμένη με ειδικά υλικά ή πολωμένη σε πολύ υψηλό δυναμικό (
kV). Συνήθως χρησιμοποιείται το "φαινόμενο χιονοστιβάδας" (avalanche effect), κατά το οποίο η αρχική εκπομπή ηλεκτρονίων δίνει αφορμή σε επιπλέον εκπομπή από πολλαπλές προσπτώσεις των δευτερογενώς παραγομένων ηλεκτρονίων και την τελική ενίσχυση του ασθενέστατου ρεύματος των αρχικών ιόντων σε μετρήσιμο ρεύμα ηλεκτρονίων. Οι συνηθέστερες τεχνικές ανίχνευσης ιόντων είναι:α
) Κύπελλο (cup) Faraday. Αποτελείται από μία κοίλη επιφάνεια, η οποία συνδέεται με ένα ηλεκτρόμετρο (συσκευή μέτρησης ηλεκτρικού φορτίου). Φορτίζεται αρνητικά με την πρόσπτωση ηλεκτρονίων στην επιφάνεια της με συνέπεια την ανταπόκριση του ηλεκτρομέτρου. Είναι μία καθαρά αναλογική μέθοδος και δεν μπορεί να λειτουργήσει με παλμικές διατάξεις. Η ευαισθησία του Faraday cup είναι σχετικά μικρή, με σημαντικό πλεονέκτημα το χαμηλό κόστος.β
) Ηλεκτρονοπολλαπλασιαστής (Secondary Electron Multiplier, SEM). Αποτελείται από μία διαδοχική σειρά δυνόδων (μεταλλικές επιφάνειες –συνήθως κράμα Cu-Be– οι οποίες εκπέμπουν δευτερογενή ηλεκτρόνια) πολωμένων σε υψηλό δυναμικό. Μπορεί να λειτουργήσει σε αναλογικές ή ψηφιακές διατάξεις, έχει καλή ευαισθησία αλλά σχετικά υψηλό κόστος.γ) Ανιχνευτής
Daly. Αποτελείται από μία μεταλλική επιφάνεια με δυνατότητα εκπομπής δευτερογενών ηλεκτρονίων τα οποία επιταχύνονται προς ένα σπινθηριστή (scintillator) και το εκπεμπόμενο φώς ανιχνεύεται από φωτοπολλαπλασιαστή.δ)
Channeltron. Αποτελείται από μία δύνοδο σε σχήμα χωνιού έχοντας ειδική επίστρωση υλικού με δυνατότητα εκπομπής δευτερογενών ηλεκτρονίων των οποίων ο αριθμός αυξάνεται σημαντικά με το "φαινόμενο χιονοστοιβάδας", δίνοντας τελικά μία ένα ρεύμα εύκολα μετρήσιμο με ένα ηλεκτρόμετρο.ε
) Πλάκα μικροδιόδων (Microchannel plate). Αποτελείται από μία συστοιχία γυάλινων τριχοειδών σωλήνων με εσωτερική διάμετρο 10-25 μm, τα οποία είναι επιστρωμένα με κατάλληλο υλικό το οποίο έχει δυνατότητα εκπομπής δευτερογενών ηλεκτρονίων. Ταυτόχρονα τα τριχοειδή βρίσκονται πολωμένα σε υψηλή τάση και με την βοήθεια του "φαινομένου χιονοστοιβάδας" παράγεται ρεύμα ενισχυμένο κατά 103 ως 104 σε σχέση με το αρχικό ρεύμα ιόντων. Ο ανιχνευτής έχει μεγάλη ευαισθησία, ενώ η δυνατότητα κατασκευής μεγάλης επιφάνειας από πολλές οπές τριχοειδών επιτρέπει την χρήση του σε συστήματα μέτρησης πολλών μαζών ταυτόχρονα (multichannel detector, focal plane array detectors) σε συνδυασμό με φίλτρο μαζών μαγνητικού πεδίου.
3. ΠΕΙΡΑΜΑΤΙΚΟ ΜΕΡΟΣ
Άσκηση 1
ΦΑΣΜΑΤΑ ΜΑΖΑΣ ΧΗΜΙΚΩΝ ΕΝΩΣΕΩΝ
Στην παρούσα άσκηση καταγράφονται τα φάσματα μάζας των He,
N2, O2, H2O, HCl, CH3OH, CH3CH2OH, CH3COCH3, C6H5CH3, CH2Cl2 και CH3I, σε ενέργεια ηλεκτρονίων 70 eV και 20 eV. Γίνεται μελέτη του μηχανισμού θραυσματοποίησης και της διαφοροποίησης των εντάσεων των λαμβανομένων ιόντων σαν συνάρτηση της ενέργειας των προσπιπτόντων ηλεκτρονίων. Στην συνέχεια γίνεται ανάλυση της θραυσματοποίησης με βάση απλούς κανόνες που διέπουν την ερμηνεία ενός φάσματος μάζας.
Ιονισμός σωματιδίων
Η πρόσπτωση ενός ηλεκτρονίου με κινητική ενέργεια Ε
kin σε ένα σωματίδιο S (άτομο ή μόριο) έχει σαν αποτέλεσμα τον ιονισμό του, αν η απαιτούμενη ενέργεια (πρώτου) ιονισμού του σωματιδίου IPS είναι το πολύ ίση με Ekin και το κατιόν S+ παράγεται διεγερμένο (αν Ekin > IPS) με εσωτερική ενέργεια Eint (η διέγερση σημειώνεται με εκθέτη αστερίσκο *):Αν το σωματίδιο
S δεν είχε ασύζευκτα ηλεκτρόνια (συνηθισμένη περίπτωση σταθερών μορίων, σημαντικές εξαιρέσεις αποτελούν μόρια περιέχοντα μεταβατικά μέταλλα καθώς και ελεύθερες ρίζες, π.χ. NO, NO2) ή είχε άρτιο αριθμό ασυζεύκτων ηλεκτρονίων (τριπλή κατάσταση, τυπικό παράδειγμα το μόριο O2), τότε το παραγόμενο κατιόν S+ είναι ταυτόχρονα μία ελεύθερη ρίζα (σημειώνεται με εκθέτη την τελεία · ) S+· . Το θετικό φορτίο και η ηλεκτρονιακή πυκνότητα που αντιστοιχεί στο ασύζευκτο ηλεκτρόνιο είναι συνήθως αποεντοπισμένα σε όλο το μόριο, αν και η παρουσία ατόμων ή ομάδων με ιδιαίτερα ηλεκτρονιακά χαρακτηριστικά, όπως η μικρή ενέργεια απόσπασης ηλεκτρονίου από μή δεσμικό μοριακό τροχιακό (ετεροάτομα Ν, Ο, P, S), ή από π-μοριακό τροχιακό συντελεί στον εντοπισμό του θετικού φορτίου σε κάποιο άτομο ή ομάδα:
Στην περίπτωση του προπανίου CH3CH2CH3, το θετικό φορτίο είναι πιθανώτατα αποεντοπισμένο σε όλο το μήκος του μορίου γιατί προφανώς δεν υπάρχει κάποια ιδιαίτερα ευνοϊκώτερη θέση για τον εντοπισμό του (συνήθως η αδυναμία εντοπισμού σημειώνεται περικλείοντας με αγκύλες [] τον χημικό τύπο του κατιόντος). Αντίθετα, στον διμεθυλαιθέρα CH3OCH3, τα ηλεκτρόνια στα μή-δεσμικά sp3 μοριακά τροχιακά του ατόμου Ο έχουν την υψηλότερη ενέργεια (συγκρατούνται χαλαρότερα) από τα υπόλοιπα ηλεκτρόνια του μορίου και ως εκ τούτου η απώλεια ηλεκτρονίου εστιάζεται σ' αυτή την περιοχή του μορίου. Παρόμοια, στο προπένιο CH3CH=CH2, τα ηλεκτρόνια στα δεσμικά π-τροχιακά του διπλού δεσμού έχουν την υψηλότερη ενέργεια και συνεπώς η απώλεια ενός π-ηλεκτρονίου είναι ενεργειακά οικονομικότερη. Φυσικά, στην τρίτη περίπτωση το θετικό φορτίο και το ασύζευκτο ηλεκτρόνιο είναι αποεντοπισμένα και στα δύο (περίπου ισοδύναμα) άτομα C του διπλού δεσμού, αν και μία προσεκτικότερη παρατήρηση θα τοποθετούσε το θετικό φορτίο στο κεντρικό άτομο C (και το ασύζευκτο ηλεκτρόνιο στην ομάδα –CH2) λόγω της ενεργειακά ευνοϊκής μεταφοράς ηλεκτρονιακής πυκνότητας από την ομάδα –CH3 στο κεντρικό άτομο C, μέσω αλληλεπικάλυψης του ατομικού p τροχιακού του κεντρικού ατόμου άνθρακα με τα τροχιακά s των ατόμων H και των υβριδικών sp3 του ατόμου C της ομάδας –CH3 (υπερσυζυγιακό φαινόμενο). Αξίζει να σημειωθεί ότι η δυνατότητα εντοπισμού του φορτίου (και του ασυζεύκτου ηλεκτρονίου) σε κάποιο (ή κάποια) τμήματα του μορίου περιορίζει τους διαθέσιμους δρόμους διάσπασης του κατιόντος και διευκολύνει την ερμηνεία και την πρόβλεψη ενός φάσματος μάζας.
Θραυσματοποίηση κατιόντων
Αν το σωματίδιο
S δεν είναι απλά ένα άτομο, το πρωτογενώς σχηματιζόμενο κατιόν S+ (μητρικό κατιόν, parent ion) είναι δυνατόν να θραυσματοποιηθεί διαδοχικά σε κατιόντα μικρότερης μάζας S1+, S2+, … και ουδέτερα μόρια Sa, Sb,… σε χρόνους που κυμαίνονται από 100 ps ως 1 ms. Αν ο χρόνος ημιζωής ενός κατιόντος Sn+ (τ = ln(2)/kuni) είναι τουλάχιστον ~1 μs, τότε επιζεί κατά την διάρκεια της τροχιάς του στο φίλτρο μαζών και φθάνει στον ανιχνευτή. Ο χρόνος ημιζωής εξαρτάται από την δομή του κατιόντος και το ποσό της περιεχόμενης εσωτερικής ενέργειας. Η σταθερά ταχύτητας της μονομοριακής του διάσπασης kuni εξαρτάται από την θερμοκρασία και μπορεί να υπολογιστεί (τουλάχιστον προσεγγιστικά) από την θεωρία μεταβατικής κατάστασης και την θεωρία RRKM (Rice-Ramsberger-Kassel-Marcus):![]()
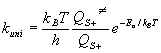
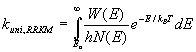
όπου
kB είναι η σταθερά του Boltzmann, h η σταθερά του Planck και T η θερμοκρασία. Η ποσότητα QS+¹ είναι η ολική συνάρτηση επιμερισμού (partition function) της μεταβατικής κατάστασης για τους εσωτερικούς βαθμούς ελευθερίας οι οποίοι δεν ανταλλάσσουν ενέργεια (παραμένουν ανενεργοί) κατά την πορεία του συστήματος προς τα προϊόντα και καλούνται αδιαβατικοί βαθμοί ελευθερίας (συνήθως δονήσεις και ορισμένοι περιστροφικοί βαθμοί ελευθερίας). Η ποσότητα QS+ είναι η ολική συνάρτηση επιμερισμού (partition function) του κατιόντος S+, και Εα είναι το ύψος του ενεργειακού φράγματος. Δομικοί και ενεργειακοί παράγοντες του κατιόντος και της μεταβατικής κατάστασης (που αντιστοιχεί σε συγκεκριμένη πορεία διάσπασης) μπορούν να προβλεφθούν από θεωρητικούς υπολογισμούς (ημιεμπειρικούς ή ab-initio), όμως υπάρχει το δύσκολο πρόβλημα της επιλογής των αδιαβατικών βαθμών ελευθερίας για τον ακριβή υπολογισμό των ποσότητων QS+¹ , QS+. Το ύψος του ενεργειακού φράγματος Εα μπορεί ευκολότερα να προβλεφθεί με θεωρητικούς υπολογισμούς των χαρακτηριστικών της ενεργειακής δυναμικής επιφάνειας της πορείας διάσπασης. H πρόβλεψη της σταθεράς ταχύτητας kuni,RRKM κατά την θεωρία RRKM απαιτεί την γνώση των ποσοτήτων W(E) και Ν(Ε). Η ποσότητα W(E) είναι ο συνολικός αριθμός πιθανών ενεργειακών καταστάσεων της μεταβατικής κατάστασης από μηδενική ενέργεια (ενέργεια μηδενικού σημείου του S+) ως ενέργεια Ε και Ν(Ε) είναι η πυκνότητα καταστάσεων του κατιόντος S+ (αριθμός καταστάσεων στο διάστημα dE) για ενέργεια Ε. Και οι δύο ποσότητες μπορούν να υπολογιστούν από την κατανομή των δονητικών και περιστροφικών επιπέδων των σωματιδίων S+¹ και S+, αντίστοιχα.Σε περιπτώσεις πολλών δρόμων ή διαδοχικών σταδίων διάσπασης ενός κατιόντος
Sn+, το πρόβλημα της πρόβλεψης των τελικών συγκεντρώσεων των διαφόρων κατιόντων είναι πολύπλοκο και θα μπορούσε να λυθεί με ένα σύστημα διαφορικών εξισώσεων (αν οι επιμέρους σταθερές ταχύτητας μονομοριακής διάσπασης είναι γνωστές). Αν η σταθερότητα του κατιόντος Sn+ είναι μεγαλύτερη από κάποιο όριο, η συγκέντρωση του δεν μηδενίζεται στο απαιτούμενο χρονικό διάστημα του ~1 ms, και ανιχνεύεται δίνοντας ένα σήμα ανάλογο της τελικής του συγκέντρωσης (στην αέρια φάση). Το διάγραμμα της έντασης ΙΜ για κάθε μάζα Μ αποτελεί και το φάσμα μάζας του συγκεκριμένου σωματιδίου S, στις εφαρμοζόμενες συνθήκες ιονισμού και μεθόδου διαχωρισμού μαζών.Η ερμηνεία ενός φάσματος μάζας βασίζεται στην αναγνώριση της μητρικής κορυφής ενός μορίου S
+ (αν υπάρχει) που αντιστοιχεί στο μοριακό βάρος του μορίου, στην ταυτοποίηση των πιθανών μοριακών τύπων των υπολοίπων κορυφών S1+, S2+,… καθώς και την μέτρηση των μεταξύ τους διαφορών μάζας εξ' αιτίας της απόσπασης των ουδετέρων θραυσμάτων Sa, Sb,… Η πορεία της διαδοχικής θραυσματοποίησης εξαρτάται από την δομή του μορίου S και μετά από συστηματική εξέταση των φασμάτων μάζας πολλών κατηγοριών μορίων (κυρίως οργανικών) έχουν βρεθεί κανόνες που απλοποιούν την διαδικασία της ερμηνείας ενός φάσματος μάζας και την εξαγωγή των πληροφοριών γύρω από την φύση της χημικής ένωσης:
Συχνά, η τεχνητή ισοτοπική επισήμανση διευκολύνει την ανάλυση και ερμηνεία ενός φάσματος μάζας, ιδιαίτερα σε περιπτώσεις αμφιβολιών που αφορούν την σύσταση ή την προέλευση ενός κατιόντος μάζας
m, με αντικατάσταση ατόμων Η (μάζα 1) από δευτέριο D (μάζα 2), ή 12C από 13C.
2. Κανόνας του αζώτου
. Στα περισσότερα στοιχεία, η αρτιότητα ή η περιττότητα της μάζας του αφθονώτερου ισοτόπου (1H, 12C, 16O, 19F, 28Si, 31P, 32S, 35Cl, 79,80Br, 127I) τυχαίνει να συμφωνεί με την αντίστοιχη ιδιότητα του αριθμού των ηλεκτρονίων τους. Σαν αποτέλεσμα, η αρτιότητα της μάζας ενός κατιόντος (στρογγυλευμένη σε ακέραιες μονάδες μάζας) υποδεικνύει ότι το κατιόν είναι ταυτόχρονα και ελεύθερη ρίζα (π.χ. Η2Ο+· :18, CH379Br+· :94, …), ενώ αν η μάζα του κατιόντος είναι περιττός αριθμός, τότε δεν έχει ασύζευκτα ηλεκτρόνια (π.χ. ΗΟ+:17, CH3+:15, CH235Cl:49, …). Τον ανωτέρω απλό κανόνα παραβιάζουν οι αζωτούχες ενώσεις, εξ' αιτίας του ότι το Ν έχει περιττό αριθμό ηλεκτρονίων (7), ενώ άρτια μάζα του αφθονώτερου ισοτόπου 14N. Ως εκ τούτου το κατιόν-ελεύθερη ρίζα NH3+· έχει μάζα 17, ενώ το κατιόν ΝΟ2+ έχει μάζα 46, και ο κανόνας διευκολύνει την ανάλυση των φασμάτων μάζας των αζωτούχων ενώσεων. 3. Αποχώρηση μικρού σταθερού μορίου: Η σταθερότητα των μικρών ουδέτερων μορίων (συνήθως :CH2, CO, Η2Ο, ΝΗ3, HF, H2S, HCN, H2C=CH2) έχει σαν συνέπεια την ευκολία αποχώρησης τους από ένα κατιόν μάζας m δίνοντας ένα άλλο μάζας κατά m-md (όπου md η μάζα του αποχωρώντος ουδέτερου μορίου). Τυπικά παραδείγματα παρουσιάζονται στην συνέχεια (η μεταφορά ηλεκτρονίων ή ηλεκτρονίου συμβολίζεται με το βέλος ):
(αποικοδόμηση ανθρακικών αλυσίδων)
4. Σχετική σταθερότητα κατιόντων και ελευθέρων ριζών:
Η θερμοδυναμική σταθερότητα των κατιόντων καθώς και των ελευθέρων ριζών που συμμετέχουν στην διαδικασία θραυσματοποίησης ή/και ενδιάμεσου ισομερισμού των κατιόντων αποτελεί κρίσιμο παράγοντα πρόβλεψης και ερμηνείας ενός φάσματος μάζας. Οι κυριότεροι κανόνες είναι:
α) Σταθερότητα των περισσότερο υποκατεστημένων καρβοκατιόντων και ελευθέρων ριζών. Το θετικό φορτίο τείνει να εστιασθεί στο άτομο άνθρακα με υποκαταστάτες ανθρακικές αλυσίδες. Το φαινόμενο βασίζεται στην σταθεροποίηση του κατιόντος εξ' αιτίας του υπερσυζυγιακού φαινομένου (όπως αναφέρθηκε προηγουμένως).
Για παράδειγμα, σύμφωνα με τον ανωτέρω κανόνα, το κατιόν (
CH3)2CH+ είναι σταθερότερο από το ισομερές του CH3CH2CH2+ και το γεγονός αυτό θα έχει τις συνέπειες: i) έντονη κορυφή σε m/z 43 στο φάσμα μάζας σε περίπτωση που το μόριο περιέχει την ομάδα (CH3)2CH- ii) τάση του προδρόμου κατιόντος να θραυσθεί με σκοπό να δώσει το κατιόν (CH3)2CH+ iii) ισομερείωση του κατιόντος CH3CH2CH2+ στο (CH3)2CH+ με 1,2-μετακίνηση ατόμου υδρογόνου. Ενα άλλο παράδειγμα αποτελεί το φάσμα μάζας του (CH3)4C (νεοπεντανίου), το οποίο κυριαρχείται από το αρκετά σταθερό κατιόν (CH3)3C+, που παράγεται με θραύση ενός δεσμού C-C:Στο επόμενο παράδειγμα του (
CH3)3CCH2CH3, η ευνοϊκότερη διαδικασία είναι της αποβολής της ρίζας CH3CH2· αντί της CΗ3· , γιατί ενώ και οι δύο πιθανές διασπάσεις δίνουν τριτοταγή σταθερά καρβοκατιόντα { (CH3)3C+ και (CH3)2C+CH2CH3 }, η αρκετά μεγαλύτερη σταθερότητα της παραγόμενης ρίζας CH3CH2· (υπερσυζυγιακό φαινόμενο, επίσης!) από την αντίστοιχη της CΗ3· συμβάλλει στην ενίσχυση της συγκεκριμένης πορείας. Συνεπώς, στο φάσμα μάζας του (CH3)3CCH2CH3, αναμένεται εντονότερη κορυφή σε m/z 57, και ασθενέστερη σε m/z 71.β) Σταθερότητα αρωματικών ή συζυγιακών κατιόντων. Το φαινόμενο οφείλεται στην εξαιρετικά μεγάλη σταθερότητα λόγω αποεντόπισης του θετικού φορτίου σε μεγάλο μέρος του μορίου που συμμετέχει στην δημιουργία κατειλημμένων δεσμικών π-μοριακών τροχιακών.
Για παράδειγμα, η θραύση ενός δεσμού
C-H στο κατιόν CH3CH+-· CH2 (μητρικό κατιόν του CH3CH=CH2) θα συμβεί στην ομάδα CH3- :εξ' αιτίας της σταθερότητας του αλλυλικού κατιόντος [
CH2CHCH2]+ (π-σύστημα με την αλληλεπικάλυψη των ατομικών p τροχιακών και των 3 ατόμων C με υβριδισμό sp2). Συνεπώς, στο φάσμα μάζας του CH3CH=CH2, αναμένεται υψηλή ένταση σε m/z 41, το οποίο επιβεβαιώνεται πειραματικά. Επιπλέον, ο σχηματισμός σταθερού αρωματικού κατιόντος παρεμποδίζει την περαιτέρω διάσπαση του και απλοποιεί το φάσμα μάζας.γ) Σταθερότητα κεκορεσμένων κυκλικών κατιόντων. Οφείλεται στην καλύτερη αποεντόπιση του θετικού φορτίου στο κυκλικό σύστημα και έχει σαν αποτέλεσμα την ευνοϊκότερη θραύση πλευρικών ομάδων του δακτυλίου, όπως στο παράδειγμα:
δ) Επέκταση συζυγιακού/αρωματικού συστήματος σε περισσότερα άτομα. Χαρακτηριστικό παράδειγμα είναι η θραύση του β-δεσμού Φ
C-C (όπου Φ ένα συζυγιακό ή αρωματικό σύστημα) μιας αλκυλομάδας συνδεδεμένη σε αρωματικό δακτύλιο και όχι του δεσμού Φ-C. Η μεγαλύτερη σταθερότητα του κατιόντος C6H5CH2+ σε σχέση με το κατιόν C6H5+ αποτελεί πιθανότατα την αιτία της κυριαρχίας της πορείας διάσπασης:Να σημειωθεί ότι στην συνέχεια το κατιόν [
C6H5CH2] + ισομερειώνεται στο αρωματικό τροπυλ-κατιόν C7H7+ (επταμελής δακτύλιος).ε) Μεταφορά του θετικού φορτίου σε ετεροάτομο Χ (
N, O, S, ..) και σχηματισμός πολλαπλού δεσμού: Η ενεργειακά ευνοϊκότερη απώλεια ηλεκτρονιακής πυκνότητας από μή-δεσμικά sp3 υβριδικά τροχιακά των ετεροατόμων έχει σαν αποτέλεσμα την μετακίνηση του θετικού φορτίου στο ετεροάτομο και την τάση ενίσχυσης της ισχύος των δεσμών γύρω του μέ σχηματισμό διπλών ή και τριπλών δεσμών. Αποτέλεσμα του φαινομένου είναι η θραύση όχι του δεσμού C-X αλλά του β-δεσμού ως προς το ετεροάτομο (C-CX), καθώς και η θραύση α-δεσμών C-H. Τυπικό παράδειγμα αποτελεί η αιθανόλη CH3CH2OH :Συνεπώς, στο φάσμα μάζας της αιθανόλης, η κορυφή σε
m/z 31 αναμένεται και είναι η εντονώτερη, σε συμφωνία με το πείραμα. Η αμέσως εντονότερη κορυφή είναι σε m/z 45 (CH3CH=O+H) από την θραύση του α-δεσμού C-H:
Η μεγαλύτερη απόδοση της πρώτης διαδικασίας διάσπασης μπορεί να αποδοθεί στην μεγαλύτερη σταθερότητα της ρίζας
CH3· σε σχέση με το άτομο Η· .ζ)
Retro Diels-Alder διαδικασίες σε ακόρεστους δακτυλίους. Συνήθως, ακόρεστοι δακτύλιοι διασπώνται με την παραγωγή ενός συζυγιακού διενίου R2C=CRCR=CR2 (R οποιαδήποτε άτομα ή ομάδες) και ενός αλκενίου R2C=CR2:
Η μεγαλύτερη σταθερότητα του κατιόντος του διενίου (συζυγία, αποεντόπιση) συντελεί στην παραμονή του θετικού φορτίου και της ασύζευκτης ηλεκτρονιακής πυκνότητας στο διένιο, ενώ το αλκένιο αποσπάται σαν ουδέτερο σωματίδιο.
5. Μεταθέσεις ατόμων ή ομάδων.
Τυπικά παραδείγματα μεταθέσεων:α) Mετακινήσεις ατόμων ή ομάδων (με σκοπό την δημιουργία σταθερότερου κατιόντος)
:
(1,2-μετακίνηση CH3)
β) Μετάθεση
McLafferty. Αφορά κατιόντα που περιέχουν ετεροάτομο Χ (συνήθως Ο), π-σύστημα (συνήθως ένα διπλό δεσμό) και άτομα υδρογόνου σε γ-θέση ως πρός το δεσμό C-X (μέσω 6-μελούς δακτυλίου, για την στερεοχημική δυνατότητα μετακίνησης του στο ετεροάτομο). Ενα τυπικό παράδειγμα:(όπου
Y = H, R, OH, OR, NR2, και R μία οποιαδήποτε ομάδα)
Τεχνικό μέρος
Στο πρώτο μέρος της άσκησης επιτελείται ο έλεγχος της ποιότητας του κενού στον θάλαμο του φασματογράφου μάζας (πρέπει η πίεση
P να είναι μικρότερη από 10-7 mbar) και των γραμμών κενού (P < 10-4 mbar). Στην συνέχεια εκκινείται ο φασματογράφος μάζας με την βοήθεια του υπευθύνου της άσκησης. Ο φασματογράφος μάζας είναι τύπου τετραπόλου, BALZERS (Liechtenstein), μοντέλλο QMG511 με ροή ιονιζόντων ηλεκτρονίων κάθετη στην ροή των μορίων (cross-beam ion source) και ηλεκτρονοπολλαπλασιαστή τεχνολογίας πολλαπλών δυνόδων Cu-Be, κάθετο στην κατεύθυνση του τετραπόλου και ηλεκτροστατική εστίαση ιόντων. Η λήψη φασμάτων πρέπει να γίνει μετά παρέλευση τουλάχιστον 30 min από την εκκίνηση της συσκευής, για την σταθεροποίηση του τετραπολικού πεδίου και την απαέρωση (degas) του θερμαινόμενου νήματος (filament) που αποτελεί την πηγή ηλεκτρονίων. Το νήμα αποτελείται από το μέταλλο ρήνιο (Re) αντί του συνηθέστερα χρησιμοποιούμενου βολφραμίου (W) για την αποφυγή χημικών αντιδράσεων ατόμων άνθρακα και οξυγόνου (carbon-oxygen cycle) πάνω στο νήμα, συχνό πρόβλημα των καθόδων βολφραμίου και αιτία της βραχυβιότητας τους. Το φάσμα μάζας οδηγείται είτε σε Χ-Υ καταγραφέα ή σε υπολογιστή για την τελική παρουσίαση του με την μορφή ιστογράμματος.
Στο δεύτερο μέρος γίνεται η παραλαβή δειγμάτων των ακολούθων μορίων:
α) αέρια He,
N2, O2 και HCl.β) πτητικά υγρά
H2O, CH3OH, CH3COCH3, C6H5CH3, CHCl3 και CH3I.Τα δείγματα βρίσκονται σε φιαλίδια με στρόφιγγα, κατάλληλα για την προσαρμογή τους σε γραμμή κενού (διαθέτουσα μετρητές πίεσης) για απαέρωση και λήψη συγκεκριμένης ποσότητας. Η απαέρωση γίνεται με την βοήθεια ψύξης σε θερμοκρασία υγρού αζώτου (77 Κ) μόνο στα μόρια που έχουν απειροελάχιστα μικρή τάση ατμών σ' αυτή την θερμοκρασία
(όλα εκτός των He, N2 και O2). Το δείγμα ψύχεται και μόλις στερεοποιηθεί εκκενώνεται σε κενό περίπου 10-4 mbar για μερικά λεπτά. Στη συνέχεια αποκόπτεται από το κενό και αφήνεται να επανέλθει σε θερμοκρασία δωματίου και την απελευθέρωση του αέρα (που πιθανά περιέχει και είναι εγκλωβισμένος στη στερεή φάση) και η διαδικασία (ψύξη-εκκένωση-τήξη, freeze-pump-thaw) επαναλαμβάνεται μέχρι σταθερότητας της μετρούμενης πίεσης όταν ανοίγει η στρόφιγγα του φιαλιδίου (ενώ το περιεχόμενο κρατείται σε θερμοκρασία 77 Κ).Η γραμμή κενού συνδέεται μέσω στροφίγγων και κατάλληλων τριχοειδών σωλήνων για τον έλεγχο της ροής των μορίων στον θάλαμο υψηλού κενού (δεν πρέπει η πίεση στο θάλαμο να ξεπεράσει την τιμή
P > 10-6 mbar). Στην συνέχεια για κάθε δείγμα, ανοίγεται η στρόφιγγα του φιαλιδίου μέχρι η πίεση του αερίου στην γραμμή κενού να είναι περίπου 1 – 10 Torr (1 bar = 760 Torr). Ενεργοποιούνται τα συστήματα ανίχνευσης ιόντων του φασματογράφου μάζας και λαμβάνονται τα φάσματα μάζας σαρώνοντας την περιοχή μαζών 1 – 200 amu σε αναλογικό καταγραφέα Χ-Υ.
Αποτελέσματα
Τα λαμβανόμενα φάσματα μάζας σε ενέργεια ηλεκτρονίων 70
eV παρουσιάζονται και αναλύονται με τη σειρά.
1. He
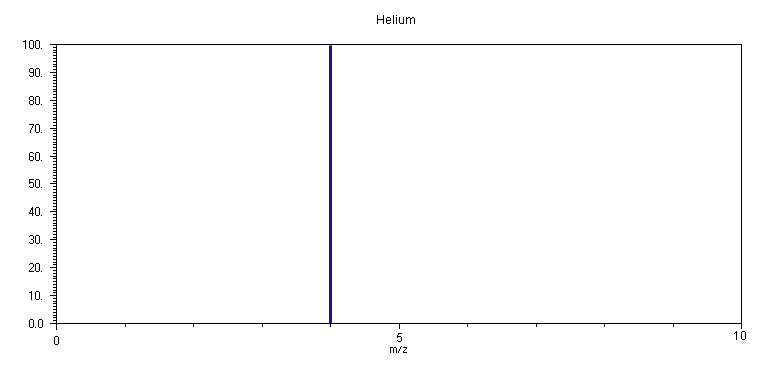
Το φάσμα μάζας του
He αποτελείται από μία μόνο κορυφή σε m/z 4, που αντιστοιχεί στο ισότοπο 4He (το ισότοπο 3He αποτελεί μόνο ένα ποσοστό 0.00013 % και δεν είναι εύκολη η παρατήρηση του στις συγκεκριμένες συνθήκες ευαισθησίας). Αν η ενέργεια των ηλεκτρονίων μειωθεί σε 20 eV, τότε το He δεν ανιχνεύεται καθ' όσον η ενέργεια ιονισμού του είναι μεγαλύτερη, 24.587 eV και η ενέργεια των ηλεκτρονίων δεν είναι αρκετή για τον ιονισμό του.
2. N2
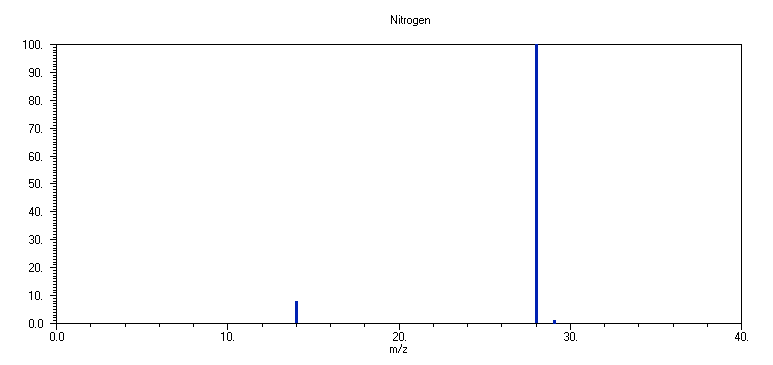
Το φάσμα μάζας του Ν
2 αποτελείται από δύο κορυφές, σε m/z 28 (14N2+) (100 %) και σε m/z 14 (14N+) (6.25 %). Το ισότοπο 15Ν βρίσκεται στη γη σε ποσοστό 0.365 % και οι κορυφές σε m/z 29 (14N15N+), m/z 30 (15N15N+) και m/z 15 (15N+) παρατηρούνται μόνο με μεγάλη ευαισθησία. Η σταθερότητα του κατιόντος N2+ (τάξη δεσμού 2.5) φαίνεται ότι συντελεί στο μικρό ποσοστό διάσπασης του μητρικού κατιόντος του N2.
3. O2
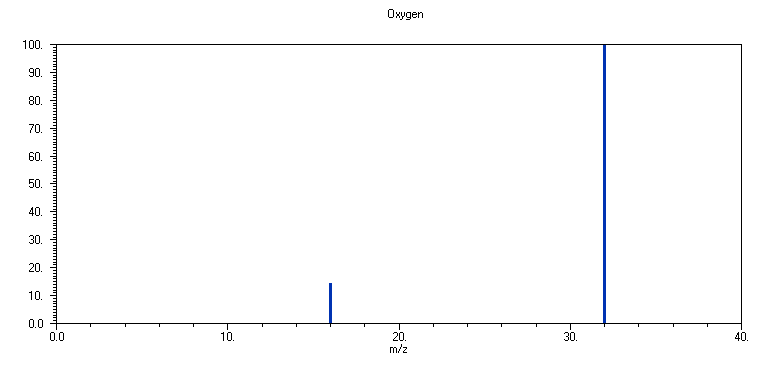
Το φάσμα μάζας του O
2 αποτελείται από δύο κύριες κορυφές, σε m/z 32 (16O2+) (100 %) και σε m/z 16 (16O+) (13 %). Τα ισότοπα 17O και 18O βρίσκονται στη γη σε ποσοστά 0.04 % και 0.20 %, αντίστοιχα. Οι κορυφές σε m/z 33 (16O17O+), m/z 34 (16O18O+, 17O17O+), m/z 35 (17O18O+) και m/z 36 (18O18O+), καθώς και σε m/z 17 (17O+) και m/z 18 (18O+) παρατηρούνται μόνο σε μεγάλη ευαισθησία. Οπως και στην περίπτωση του Ν2, η μεγάλη σταθερότητα του κατιόντος Ο2+ (τάξη δεσμού 2.5, ο ιονισμός συμβαίνει από μοριακά τροχιακά του Ο2 έχοντα αντιδεσμικό χαρακτήρα) συντελεί στο μικρό ποσοστό διάσπασης του μητρικού κατιόντος του Ο2.Στο φάσμα μάζας του αέρα (μπορεί επίσης να ληφθεί κατά τη διάρκεια της άσκησης), ο λόγος των εντάσεων 28/32 (αγνοώντας την μικρή θραυσματοποίησης κάθε μορίου) δεν αντιστοιχεί στην ποσοστιαία σύσταση του αέρα σε Ν
2 και Ο2 (78 και 21 %, αντίστοιχα). Αντίθετα, οι κανονικοποιημένες εντάσεις των κορυφών 28 και 32 είναι περίπου 100 και 21. Οι λόγοι αυτής της διαφοροποίησης είναι αφ' ενός ο εκτενέστερος θρυμματισμός του Ο2, που μειώνει την ένταση της μητρικής κορυφής και η συνεισφορά του CO+ (m/z 28) στην ένταση της μητρικής κορυφής του Ν2. Το κατιόν CO+ είναι θραύσμα του CO2 (που υπάρχει στον ατμοσφαιρικό αέρα) και συχνά σχηματίζεται από αντιδράσεις κατιόντων O+ και Ο2+ με το στρώμα άνθρακα που υπάρχει γύρω από την περιοχή ιονισμού από την θερμική διάσπαση οργανικών ενώσεων (δείγματα ή λάδια αντλιών κενού).Οι ποσοτικές μετρήσεις με φασματογραφία μάζας προϋποθέτουν την βαθμονόμηση των εντάσεων συγκεκριμένων κορυφών της ένωσης, χρησιμοποιώντας πρότυπο δείγμα καθαρής ένωσης, συναρτήσει της συγκέντρωσης της στο θάλαμο χαμηλού κενού, εξ' αιτίας της των διαφορετικών ενεργών διατομών ιονισμού (διαφορετικές ενέργειες ιονισμού) και των ποσοστών θραυσματοποίησης κάθε ένωσης.
4. HCl
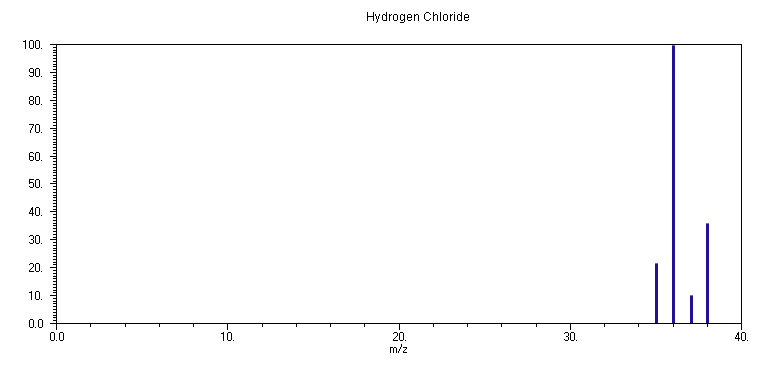
Το φάσμα μάζας του HCl εξαρτάται χαρακτηριστικά από την εφαρμοζόμενη ενέργεια των ιονιζόντων ηλεκτρονίων. Συγκεκριμένα, σε ενέργεια 70
eV, το φάσμα αποτελείται από τις ισοτοπικές κορυφές του κατιόντος HCl+ (m/z 36: 100 %, m/z 38: 32 %) καθώς και του θραύσματος Cl+ (m/z 35: 17 % και m/z 37: 5 %), αντικατοπτρίζοντας την γήινη ισοτοπική σύσταση του Cl, 35Cl: 75% και 37Cl: 25%. Καθώς η ενέργεια των ηλεκτρονίων μειώνεται, παρατηρείται αντίστοιχη μείωση στην ένταση των κορυφών του Cl+, μέχρι περίπου 20 eV, όπου εξαφανίζονται. Η ενέργεια ιονισμού του HCl είναι 12.74 eV και προφανώς σε ενέργεια EI < 20 eV η εσωτερική ενέργεια του κατιόντος HCl+ δεν επαρκεί για την ενδόθερμη θραύση του σε κατιόν Cl+ και άτομο Η. Η ιδιότητα αυτή του HCl μπορεί να εφαρμοστεί στην απαρεμπόδιστη μέτρηση της συγκέντρωσης των ατόμων Cl, παρουσία πολλαπλασίων συγκεντρώσεων HCl.
5. H2
Ο
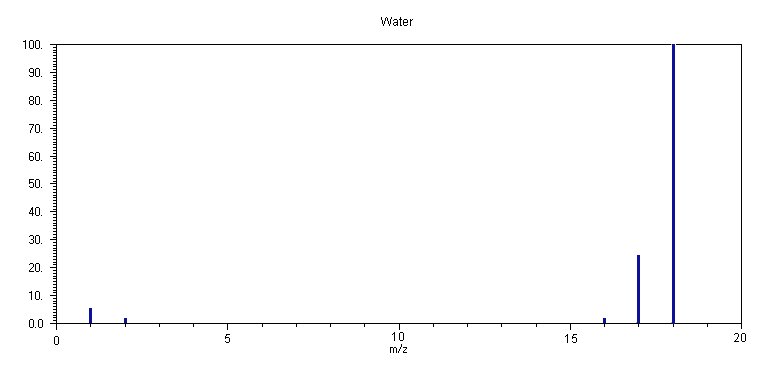
Το φάσμα μάζας του H
2Ο στα 70 eV απαρτίζεται από δύο κύριες κορυφές, σε m/z 18 (H2O+) (100 %) και σε m/z 17 (HO+) (25 %), και αρκετά μικρότερες σε m/z 1 (H+) (6 %), m/z 2 (H2+, D+) (2.2 %) και σε m/z 16 (O+) (2.3 %). Το φάσμα μάζας του H2O εξαρτάται επίσης από την ενέργεια των ηλεκτρονίων και σε ενέργεια 20 eV, απαρτίζεται σχεδόν μόνο από την μητρική κορυφή σε m/z 18.Οι διαδικασίες ιονισμού και θραυσματοποίησης του
H2O είναι:
Η εντονώτερη κορυφή οφειλόμενη σε θραύσμα είναι σε
m/z 17 (OH+), υποδεικνύοντας ότι η διαδικασία (5.1) επικρατεί έναντι των (5.2), (5.3) και (5.4). Η μεγαλύτερη σταθερότητα του κατιόντος OH+, λόγω εκτενέστερης αποεντόπισης του φορτίου (με συμμετοχή και μη-δεσμικών τροχιακών) σε σύγκριση με τα κατιόντα H+, Η2+ και Ο+ είναι ένας βασικός λόγος αυτής της συμπεριφοράς. Αυτό το επιχείρημα ενισχύεται και από την σύγκριση των ενεργειών ιονισμού των OH (13.17 eV), H (13.598 eV), H2 (15.427 eV) και O (13.618 eV) – το υδροξύλιο ΟΗ έχει την χαμηλώτερη ενέργεια ιονισμού.
6. CH3
ΟH
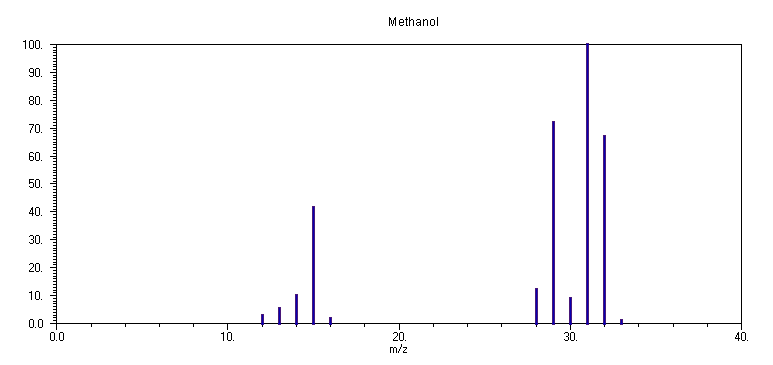
Το φάσμα μάζας της μεθανόλης
CH3OH στα 70 eV απαρτίζεται από τις κορυφές: m/z 31 (100%), μητρική σε m/z 32 (67 %), m/z 30 (9.5%), m/z 29 (71%), 28 (13 %), 16 (2.5 %), 15 (42 %), 14 (10.5 %), 13 (6 %), 12 (4 %) και m/z 33 (2 %). Η αντίστοιχη ταυτοποίηση των κορυφών είναι: 31: CH2O+H, 32: CH3O+H, 30: CH2O+, 29: HCO+, 28: CO+, 16: O+, 15: CH3+, 14: CH2+, 13: CH+, 12: C+. Η κορυφή σε m/z 33 αντιστοιχεί στο κατιόν CH3OH2+, το οποίο σχηματίζεται από διμοριακές κρούσεις ιόντος-μορίου στην περιοχή ιονισμού, από μεταφορά ατόμου υδρογόνου:
Παρόμοιες αντιδράσεις συμβαίνουν πάντα με μόρια που περιέχουν ετεροάτομα X (X =
N, O, S) και η ένταση της κορυφής του κατιόντος RnXH+ σε m/z (Μ+1), όπου Μ η μοριακή μάζα της ένωσης RnX, αυξάνεται με την πίεση του δείγματος και τον χρόνο παραμονής των κατιόντων στην περιοχή ιονισμού.Οι διαδικασίες ιονισμού και θραυσματοποίησης της
CH3OH είναι:
Το μητρικό κατιόν
CH3OH+ έχει δύο πιθανά πρωτογενή κανάλια διάσπασης, α) απόσπαση ενός ατόμου Η (6.1), ή β) θραύση του δεσμού C-O (6.2). Η απόσπαση Η θα συμβεί από το άτομο C για να σχηματισθεί το κατιόν CH2=O+H, στο οποίο, η ηλεκτροφιλία του θετικά φορτισμένου ατόμου Ο ικανοποιείται από την προσέγγιση της ομάδας CH2 και σχηματισμό διπλού δεσμού (αύξηση της ηλεκτρονιακής πυκνότητας γύρω από το άτομο Ο). Αντίθετα, το πιθανό κατιόν CH3O+ το οποίο θα σχηματισθεί με θραύση του δεσμού Ο-Η, δεν έχει την ίδια πιθανότητα σταθεροποίησης και συνεπώς δεν ευνοείται θερμοδυναμικά ο σχηματισμός του. Το δεύτερο κανάλι της θραύσης του δεσμού C-O, θα οδηγήσει σε CH3+ και ΟΗ, και όχι σε CH3 και ΟΗ+, λόγω της μεγάλης ηλεκτραρνητικότητας του ΟΗ και κατ' επέκταση της ενέργειας που απαιτείται για τον ιονισμό του (πράγματι, τα δυναμικά ιονισμού τους είναι: CH3 9.83 eV, OH 13.17 eV). Η ποσοτική σύγκριση των δύο πρωτογενών διαδικασιών διάσπασης του μητρικού κατιόντος δείχνει την ελαφρά υπεροχή της θραύσης του δεσμού C-H, και μπορεί να εξηγηθεί με βάση της αναμενόμενη σταθερότητα του μεγαλύτερου κατιόντος CH2=OH+ (έναντι του CH3+) λόγω εκτενέστερης αποεντόπισης και συγκράτησης του θετικού φορτίου. Η παραιτέρω δευτερογενής διάσπαση των κατιόντων CH2=OH+ και CH3+ οδηγεί μέσω διαδοχικών αποσπάσεων ατόμων Η στα υπόλοιπα κατιόντα με συνεχώς φθίνουσα ένταση. Απόκλιση από τον κανόνα φαίνεται να είναι η κορυφή σε m/z 30 (CH2O+), η οποία είναι ταυτόχρονα και ελεύθερη ρίζα, με αποτέλεσμα να έχει μειωμένη σταθερότητα και και να διασπάται έντονα πρός το επόμενο σταθερότερο κατιόν HCO+.Από την εξέταση του φάσματος μάζας προκύπτει η διαπίστωση ότι η ισχυρότερη κορυφή δεν είναι η μητρική κορυφή σε
m/z 32, αλλά ένα θραύσμα του μητρικού κατιόντος σε m/z (M-1). Η μικρή ένταση της μητρικής κορυφής είναι ένας γενικός κανόνας των φασμάτων μάζας των αλκοολών ενώ ή επικράτηση της κορυφής σε m/z 31 (με θραύση του α-δεσμού C-C) αφορά τα φάσματα μάζας των πρωτοταγών αλκοολών RCH2OH.
7. CH3COCH3
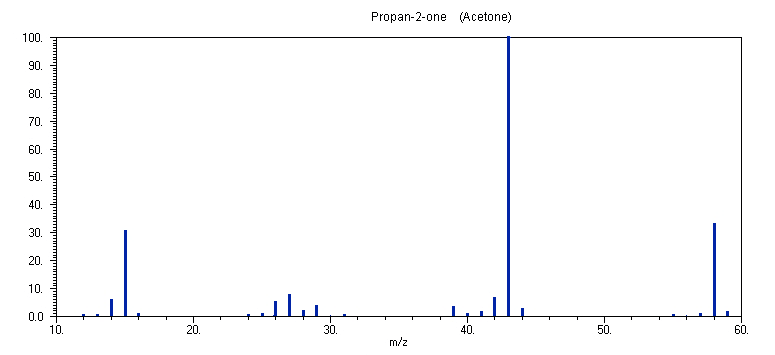
Το φάσμα μάζας της ακετόνης
CH3COCH3 στα 70 eV απαρτίζεται από τις κορυφές: m/z 43 (100 %), μητρική 58 (32 %), 57 (1 %), 44 (4 %), 42 (7 %), 41 (2 %), 40 (1 %), 39 (4 %), 29 (5 %), 28 (2 %), 27 (7 %), 26 (6 %), 25 (1 %), 15 (31 %), 14 (6 %), και την κορυφή σε m/z 59 (2 %), που αντιστοιχεί στο κατιόν CH3C(=OH+)CH3 με μάζα (Μ+1). Η αντίστοιχη ταυτοποίηση των κορυφών είναι: 43: CH3CO+, μητρική 58: CH3COCH3+, 57: CH3COCH2+, 44: CH3CHO+, 42: CH2CO+, 41: CHCO+, 40: CCO+, 29: CH3CH2+, 28: (CO+, CH2=CH2+), 27: CH2=CH+, 26: HCº CH+, 25: HCº C+, 15: CH3+, 14: CH2+. Με βάση τα ανωτέρω, το πιθανότερο σχήμα ιονισμού και θραυσματοποίησης της ακετόνης είναι:Ιονισμός
:
Πρωτογενή κανάλια διάσπασης:
Διάσπαση του κατιόντος
CH3Cº O+:
Ισομερείωση και διάσπαση του κατιόντος
CH3C(=O)CH2+:
Ο ιονισμός της ακετόνης οδηγεί στο κατιόν
CH3C(=O+)CH3, με εντοπισμό του θετικού φορτίου στην περιοχή του ατόμου του Ο, όπως έχει ήδη συζητηθεί. Τα πρωτογενή κανάλια διάσπασης του μητρικού κατιόντος αναγκαστικά περιλαμβάνουν θραύσεις δεσμών, με τρεις πιθανές διαδικασίες: C-C, C-H, C-O. Η θραύση του δεσμού C-O πρέπει αρχικά να αποκλεισθεί, λόγω της μεγάλης ισχύος του διπλού δεσμού C=O. Η θραύση του δεσμού C-C είναι ευνοϊκή, συντελώντας σε σχηματισμό είτε CH3Cº O+ και CH3, ή σε CH3C=O και CH3+ (η παραμονή του θετικού φορτίου στο σχετικά σταθερό κατιόν CH3Cº O+ είναι περισσότερο ευνοϊκή). Η διάσπαση ενός δεσμού C-H οδηγεί στο κατιόν CH3C(=O)CH2+ με αδυναμία επαρκούς σταθεροποίησης του θετικού φορτίου. Η εξέταση των σχετικών εντάσεων του φάσματος μάζας δείχνει ότι όντως το κανάλι της θραύσης του δεσμού C-C επικρατεί και η κορυφή σε m/z 43 είναι η εντονότερη. Αυτή η διαδικασία συμβαίνει έντονα σε καρβονυλικές ενώσεις R1C(=O)R2 όπου στο φάσμα μάζας τους επικρατούν οι κορυφές των κατιόντων R1Cº O+ και R2Cº O+.Στη συνέχεια, το κατιόν
CH3Cº O+ διασπάται δίνοντας τα θραύσματα CH3+, CH2+, CO+, CH2C=O+, CHCO+, CCO+ με τις αντιδράσεις (7.1.1a) ώς (7.1.5). Αξίζει να παρατηρηθεί η απόσπαση του μικρού σταθερού μορίου CO στην αντίδραση (7.1.1a).Του κατιόν
CH3C(=O)CH2+ με μάζα (Μ-1) που σχηματίσθηκε από την θραύση ενός δεσμού C-H δεν είναι αρκούντως σταθερό και διασπάται γρήγορα είτε με θραύση του δεσμού C-C (αντίδραση 7.2.7) και αποχώρηση του σταθερού CO πρός κατιόν CH3+, ή σε κατιόν CH3CH2+ και CO (αντίδραση 7.2.1) μέσω ενδιάμεσου ισομερισμού στο σταθερότερο κατιόν CH3CH2Cº O+ (με μετακίνηση της ομάδας CH3). Η αστάθεια του CH3C(=O)CH2+ εξηγεί και την μικρή ένταση της κορυφής του στο φάσμα μάζας. Τα κατιόντα CH3+ και CH3CH2+ στη συνέχεια διασπώνται πρός CH2+, CH+, C+ και CH3+, CH2=CH2+, CH2=CH+, HCº CH+, HCº C+. Αξίζει να σημειωθεί η αντίδραση (7.2.3) που αφορά την αποχώρηση του μικρού μορίου CH2 που είναι μία σημαντική διαδικασία σταδιακής αποικοδόμησης κατιόντων περιέχοντα ανθρακικές αλυσίδες RCH2+, με διαδοχικές αποσπάσεις του καρβενίου CH2.8. C6H5CH3
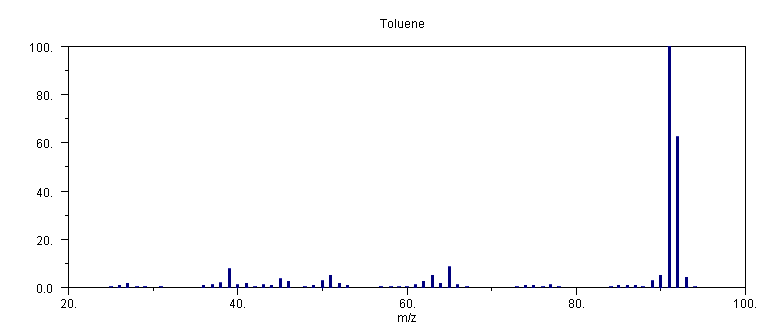
Το φάσμα μάζας του τολουολίου
C6H5CH3 στα 70 eV απαρτίζεται από αρκετές κορυφές, εκ των οποίων οι μεγαλύτερες και χαρακτηριστικότερες είναι: m/z 91 (100%), μητρική σε m/z 92 (62 %), m/z 90 (5 %), m/z 89 (3 %), m/z 65 (9 %), m/z 63 (6 %), m/z 51 (5 %), m/z 45 (4 %), m/z 39 (9 %) και η κορυφή που αντιστοιχεί στο κατιόν C6H6CH3+ (μέσω αντιδράσεων μεταφοράς Η μεταξύ ιόντος – μορίου) με μάζα (Μ+1) σε m/z 93 (4 %). Η αντίστοιχη ταυτοποίηση τους μπορεί να είναι: 91: C7H7+, 92: C6H5CH3+, 90: C7H6+, 89: C7H5+, 65: C5H5+, 63: C5H3+, 51: C4H3+, 39: C3H3+. Η κορυφή σε m/z 45 δεν μπορεί να εξηγηθεί απλά, διότι αν αντιστοιχεί σε απλά φορτισμένο κατιόν πρέπει να έχει τον τύπο C3H9+, αδύνατον από δομική άποψη. Συνεπώς, η κορυφή σε m/z 45 είτε α) οφείλεται στο διπλά φορτισμένο κατιόν C7H6++ ή β) σε κατιόν το οποίο διασπάστηκε κατά την διάρκεια της κίνησης του στο φίλτρο μαζών και η εμφάνιση του στην συγκεκριμένη θέση δεν αντιστοιχεί στην παρατηρούμενη ποσότητα m/z.Στην πρώτη περίπτωση, το κατιόν
C7H6++ μπορεί να προέλθει από την αποχώρηση του μικρού σταθερού μορίου H2 από το διπλά φορτισμένο μητρικό κατιόν C6H5CH3++, θεωρώντας ότι ο σχηματισμός του τελευταίου δεν είναι ιδιαίτερα ενεργειακά απαιτητικός (θεωρώντας ότι το δυναμικό πρώτου ιονισμού του τολουολίου είναι αρκετά χαμηλό, 8.82 eV) και η δυνατότητα των αρωματικών συστημάτων να συγκρατούν ηλεκτρονιακό φορτίο ή ασύζευκτη ηλεκτρονιακή πυκνότητα.Η δεύτερη περίπτωση σχετίζεται με τα μετασταθή κατιόντα
(metastable ions) Rm+ τα οποία είναι σχετικά μακρόβια και θραυσματοποιούνται (σε προϊόντα R+ + Q) στο φίλτρο μαζών. Συνεπώς, αν και εισέρχονται στο φίλτρο μαζών με μάζα m = mRm, αναλύονται με μάζα m = mR, και τελικά εμφανίζονται σε θέση η οποία αντιστοιχεί σε μάζα m » (mR2)/mRm, και μάλιστα η κορυφή εμφανίζεται ασυνήθιστα ευρύτερη από τις άλλες. Το μεγαλύτερο εύρος των μετασταθών κορυφών οφείλεται στη διάσπαση του κατιόντος σε διάφορες θέσεις κατά την διάρκεια της κίνησης του στο φίλτρο μαζών. Μεγάλη πιθανότητα εμφάνισης μετασταθών κορυφών αναμένεται σε αρωματικά συστήματα, και το τολουόλιο αποτελεί ένα χαρακτηριστικό παράδειγμα. Με βάση την ανωτέρω προσεγγιστική σχέση, η κορυφή σε m/z 45 πιθανώς αντιστοιχεί στην θραυσματοποίηση του κατιόντος C7H7+ με m/z 91, στο κατιόν C5H4+ με λόγο m/z 64 (642/91 = 45.01), με αποβολή της βινυλικής ελεύθερης ρίζας CH2=CH. Παρόμοια, και η κορυφή σε m/z 90 αποτελεί μία μετασταθή κορυφή (προσεκτική παρατήρηση του φάσματος μάζας στο επόμενο σχήμα, πρίν την αναπαράσταση με την μορφή ιστογράμματος, δείχνει ότι είναι σχετικά ευρεία), και οφείλεται στην σχετικά αργή διάσπαση του μητρικού κατιόντος με m/z 92 στο κατιόν C7H7+ με μάζα 91 (m = 912/92 = 90.01).
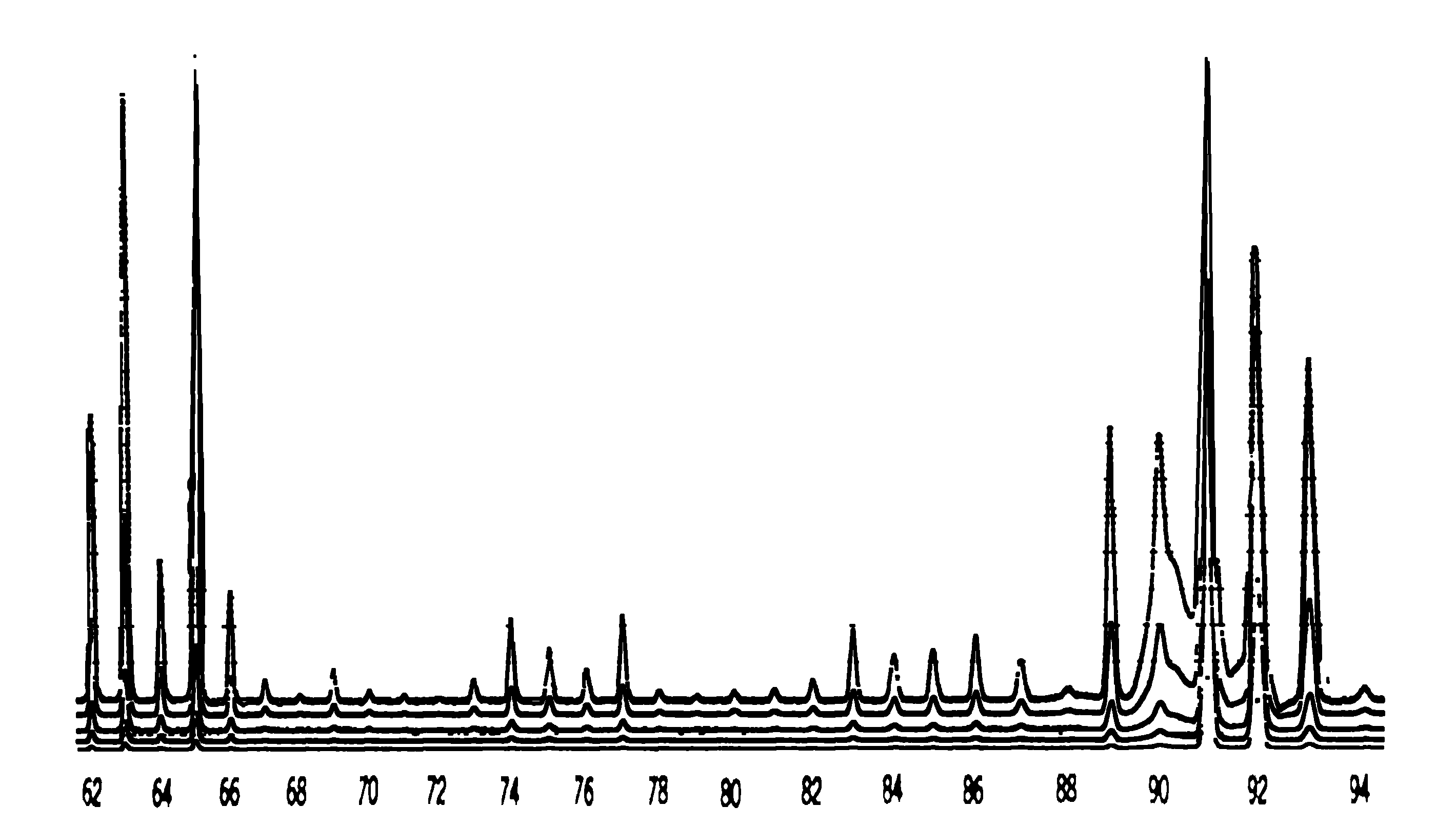
Οι παρατηρούμενες κύριες κορυφές του φάσματος μάζας του
C6H5CH3 μπορούν να εξηγηθούν με το κατωτέρω σχήμα αντιδράσεων:Ιονισμός:
C6H5CH3
C6H5CH3+ + e- (8.0)
Πρωτογενή κανάλια διάσπασης:
Ο ιονισμός του
C6H5CH2 αναμένεται να οδηγεί στο κατιόν C6H5CH3+ με εντοπισμό του θετικού φορτίου στον αρωματικό δακτύλιο. Τα κυριώτερα κανάλια διάσπασης του μητρικού κατιόντος αφορούν την θραύση είτε του δεσμού C-H ή του δεσμού C-CH3. H θραύση του δεσμού C-H οδηγεί σε ένα σχετικά σταθερό κατιόν C6H5CH2+, για το οποίο υπάρχουν ισχυρές ενδείξεις ότι ισομερίζεται στο αρωματικό κυκλικό κατιόν τροπύλιο C7H7+ (εισαγωγή της ομάδας CH2 στον δακτύλιο και μετακίνηση ενός ατόμου Η):
Στη συνέχεια το τροπυλ-κατιόν
C7H7+ διασπάται με αποβολή του μικρού σταθερού μορίου HCº CH (ακετυλένιο) στο κυκλοπενταδιενυλ-κατιόν C5H5+ με λόγο m/z 65, το οποίο με διάνοιξη του δακτυλίου και διαδοχικές αποσπάσεις είτε μορίων H2 ή ατόμων Η, δίνει τα ιόντα με λόγους m/z 64, 63, 62, 61:
Η λιγότερο ευνοϊκή θραύση του δεσμού
C-CH3 στο μητρικό κατιόν οδηγεί στο φαινυλ-κατιόν C6H5+ με ασθενή κορυφή σε λόγο m/z 77, το οποίο είτε με απόσπαση HCº CH δίνει το κατιόν C4H3+ με λόγο m/z 51, ή με διάνοιξη του εξαμελούς δακτυλίου και διαδοχική απόσπαση H2 και Η δίνει την σειρά των ασθενών κορυφών με m/z 76, 75, 74.Πάντως, μία προσεκτική παρατήρηση του φάσματος δείχνει ότι υπάρχουν ασθενείς κορυφές που αντιστοιχούν σε όλα σχεδόν τα πιθανά κατιόντα που περιέχουν από 7 έως 2 άτομα
C, που παράγονται από διαδοχικές διασπάσεις των προδρόμων κατιόντων.
9. CHCl3
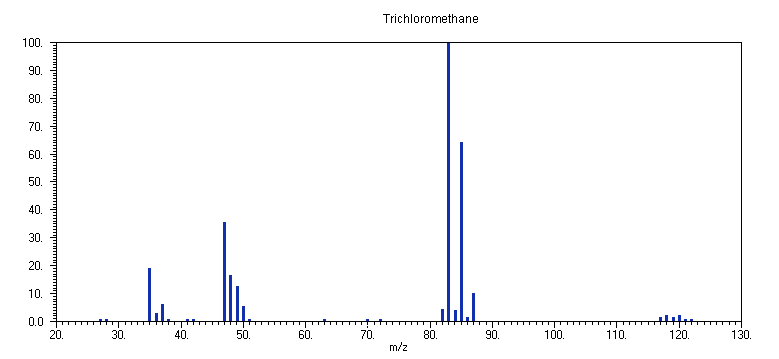
Το φάσμα μάζας του τριχλωρομεθανίου (χλωροφόρμιο)
CHCl3 στα 70 eV απαρτίζεται από αρκετές κορυφές, οι περισσότερες των οποίων είναι πολλαπλές (ισοτοπικές), λόγω της φυσικής παρουσίας των δύο ισοτόπων του Cl, 35Cl και 37Cl, σε αναλογία περίπου (3:1). Συγκεκριμένα, τα κατιόντα που περιέχουν μόνο το αφθονότερο ισότοπο 35Cl εμφανίζονται σε: m/z 83 (100 %, CH35Cl2+), μητρικό m/z 118 (2.5%, CH35Cl3+), m/z 117 (1%, C35Cl3+), m/z 82 (6%, C35Cl2+), m/z 48 (17%, CH35Cl+), m/z 47 (35%, CH35Cl+), και m/z 35 (19%, 35Cl+).Οι πιθανότερες διαδικασίες ιονισμού και θραυσματοποίησης του
CHCl3 είναι:Ιονισμός:
Πρωτογενή κανάλια διάσπασης:
Διάσπαση των πρωτοταγώς σχηματισθέντων κατιόντων:
Τα δύο πιθανά πρωτοταγή κανάλια διάσπασης είναι η θραύση ενός
C-Cl δεσμού και η θραύση του C-H δεσμού. Η πρώτη διαδικασία αναμένεται να είναι θερμοδυναμικά ευνοϊκότερη, λόγω της χαλαρότητας του δεσμού C-Cl σε σύγκριση με τον δεσμό C-H (μέση ισχύς δεσμών C-Cl και C-H περίπου 355 kJ/mol και 420 kJ/mol, αντίστοιχα), όπως επαληθεύεται από την μεγάλη ένταση της κορυφής σε m/z 83 του κατιόντος CHCl2+ καθώς και των κορυφών των ισοτοπομερών του. Ταυτόχρονα, η ένταση της κορυφής του CCl3+ που οφείλεται στην θραύση του δεσμού C-H είναι μόνο 1%, αν και το κατιόν CCl3+ αναμένεται να είναι λίγο σταθερότερο από το CHCl2+, λόγω καλύτερης αποεντόπισης του θετικού φορτίου στα 3 ογκώδη άτομα Cl. Στα αλκυλαλογονίδια RX (X = Cl, Br και Ι), η θραύση του ασθενέστερου δεσμού C-X είναι ο κύριος δρόμος θραυσματοποίησης. Το θετικό φορτίο παραμένει στο οργανικό τμήμα, λόγω των σχετικά υψηλών δυναμικών ιονισμού των ατόμων αλογόνου (12.967, 11.814 και 10.451 eV, για τα Cl, Br και Ι, αντίστοιχα), και των χαμηλών δυναμικών ιονισμού των οργανικών ριζών (π.χ., 9.83 και 9.30 eV των CH3 και CHCl2, αντίστοιχα).Η επακόλουθη θραύση των κατιόντων
CHCl2+ και CCl3+ συμβαίνει κυρίως με αποβολή ενός ουδετέρου ατόμου Cl, ή αποβολή των ουδετέρων καρβενίων CHCl και CCl2.
10. CH3I
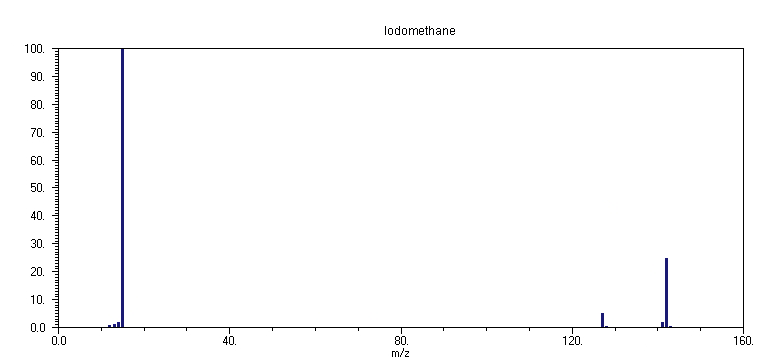
Το φάσμα μάζας του ιωδομεθανίου
CH3I στα 70 eV είναι σχετικά απλό, αποτελούμενο κυρίως από την εντονότερη κορυφή σε m/z 15 (100%, CH3+), την μητρική κορυφή σε m/z 142 (24%, CH3I+) και την κορυφή σε m/z 127 (4%, Ι+). Μικρής έντασης κορυφές εμφανίζονται σε m/z 141 (2%, CH2I+), καθώς και σε m/z 14, 13 και 12 (CH2+, CH+, και C+, αντίστοιχα). Το στοιχείο ιώδιο βρίσκεται στη φύση αποκλειστικά με την μορφή ενός μόνο ισοτόπου, του 127I.Οι διαδικασίες ιονισμού και θραυσματοποίησης του
CH3I είναι:Ιονισμός
:
Πρωτογενή κανάλια διάσπασης:
Διάσπαση των πρωτοταγώς σχηματισθέντων κατιόντων:
Ο ιονισμός του CH3I οδηγεί στο κατιόν CH3I+, έχοντας το θετικό φορτίο αποεντοπισμένο μεταξύ των ατόμων C και Ι, με γνώμονα την σχετικά μικρή ηλεκτραρνητικότητα του Ι, σε σύγκριση με τα άλλα αλογόνα. Αν και ο δεσμός C-I είναι ο ασθενέστερος ανάμεσα στους δεσμούς C-X (X=F, Cl, Br, I) στα αλκυλαλογονίδια RX, με τυπικό μέγεθος ισχύος δεσμού 240 kJ/mol, τα κατιόντα των αλκυλιωδιδίων είναι τα σταθερότερα από τα υπόλοιπα αλκυλαλογονίδια και η μητρική τους κορυφή έχει σχετικά μεγάλη ένταση στο φάσμα μάζας (σε σύγκριση με τις μητρικές κορυφές των RF, RCl, RBr). Πάντως, η ευκολία θερμικής διάσπασης των ιωδιδίων στην θερμή περιοχή της περιοχής ιονισμού (λόγω του πυρακτωμένου νήματος Re) του φασματογράφου μάζας έχει σαν αποτέλεσμα διαφορές στα φάσματα μάζας που λαμβάνονται με διαφορετικά συστήματα και διατάξεις της πηγής ηλεκτρονίων.
Η διάσπαση του μητρικού κατιόντος
CH3I+ μπορεί να ακολουθήσει τρείς διαφορετικούς δρόμους: α) θραύση του δεσμού C-I, β) θραύση του δεσμού C-H και γ) απόσπαση HI. Η θραύση του δεσμού C-I συντελεί κυρίως στην παραγωγή του κατιόντος CH3+, αν και η σχετικά μικρή διαφορά ανάμεσα στα δυναμικά πρώτου ιονισμού των σωματιδίων CH3 και Ι (9.83 και 10.451 eV, αντίστοιχα) σε συνδυασμό με την σταθερότητα της ελεύθερης ρίζας CH3, πιθανά οδηγεί στην παραγωγή Ι+ και της ρίζας CH3. Το κατιόν CH3+, στη συνέχεια διασπάται, δίνοντας την σειρά των κατιόντων CH2+, CH+, και C+ σε m/z 14, 13 και 12, αντίστοιχα.Η θραύση του δεσμού
C-H είναι λιγότερο ευνοϊκή, από θερμοδυναμική άποψη (λόγω της μεγάλης ισχύος του δεσμού C-H) και οδηγεί στο κατιόν CH2I+, το οποίο πιθανώς θραυσματοποιείται σε I+ και CH2. Η ενδομοριακή απόσπαση ΗΙ (αντίδραση 10.3) εξηγεί την παραγωγή του κατιόντος HI+ (σε m/z 128) και ενδιάμεσα πιθανώς περιλαμβάνει την μεταφορά ενός ατόμου Η στο άτομο του Ι:
Άσκηση 2
ΣΥΣΧΕΤΙΣΗ ΤΩΝ ΕΝΤΑΣΕΩΝ ΤΟΥ ΦΑΣΜΑΤΟΣ ΜΑΖΑΣ
ΜΕ ΤΗΝ ΣΥΓΚΕΝΤΡΩΣΗ ΤΩΝ ΧΗΜΙΚΩΝ ΕΝΩΣΕΩΝ
ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΕΥΑΙΣΘΗΣΙΑΣ - ΒΑΘΜΟΝΟΜΗΣΗ
Ο σκοπός της άσκησης είναι η εύρεση της ποσοτικής συσχέτισης της συγκέντρωσης με τις εντάσεις των κορυφών του φάσματος μάζας μιας χημικής ένωσης σε καθορισμένες συνθήκες (βαθμονόμηση), με σκοπό τον ποσοτικό προσδιορισμό της σε ένα μίγμα χημικών ενώσεων.
Τεχνικό μέρος
Στην παρούσα άσκηση θα βαθμονομηθεί η ευαισθησία ανίχνευσης του διμεθυλοδισουλφιδίου
CH3SSCH3 (DMDS) με τον φασματογράφο μάζας BALZERS QMG511. Στο πρώτο μέρος της άσκησης θα παρασκευασθεί ένα μίγμα DMDS 5% σε He, και στο δεύτερο μέρος θα γίνει το πείραμα της βαθμονόμησης.Η παρασκευή του μίγματος
DMDS/He γίνεται σε γυάλινη φιάλη (προσαρτημένη στην γραμμή κενού), η οποία έχει κατάλληλο σχήμα για την δυνατότητα ψύξης του περιεχομένου της σε θερμοκρασία υγρού N2 (-196 oC, 77 K). Με την βοήθεια των μετρητών πίεσης στα διάφορα σημεία της γραμμής κενού, μία ποσότητα περίπου 10 Torr ατμών (προηγουμένως απαερωμένου) DMDS σε θερμοκρασία δωματίου (σ.τ. –85 oC, σ.ζ. +110 oC) εισάγεται στη φιάλη και ψύχεται σε θερμοκρασία υγρού αζώτου. Αξίζει να παρατηρηθεί ότι το περιεχόμενο DMDS στερεοποιείται στα γυάλινα τμήματα της φιάλης σε επαφή με το υγρό άζωτο δίνοντας ένα λευκό επίστρωμα (η διαδικασία της στερεοποίησης χρειάζεται χρόνο, περίπου 5 min). Η φιάλη εκκενώνεται για περίπου 10 min, ενώ η ψύξη διατηρείται (η τάση ατμών του DMDS στους –196 oC είναι αμελητέα). Στη συνέχεια, ποσότητα He (περίπου 190 Torr) εισάγεται στη φιάλη και το περιεχόμενο αφήνεται για χρόνο περίπου 30 min σε θερμοκρασία δωματίου για να ομογενοποιηθεί (ίσως χρειαστεί εξωτερική ελαφρά θέρμανση της φιάλης για την επιτάχυνση της εξάτμισης/εξάχνωσης του DMDS και της ομογενοποίησης). Η περιεκτικότητα c του μίγματος σε DMDS δίνεται από την σχέση: c = PDMDS/Pολική = PDMDS/(PDMDS+PHe). Να σημειωθεί ότι σε παρόμοιες περιπτώσεις, ισχυρή και παρατεταμένη θέρμανση του μίγματος αντενδείκνυται για να αποφευχθεί πιθανή θερμική διάσπαση της χημικής ένωσης.Στη γραμμή κενού βρίσκεται προσαρτημένος γυάλινος θάλαμος τροφοδοσίας, ο οποίος διαθέτει μετρητή πιέσεως (
P1) και συνδέεται με τον θάλαμο του φασματογράφου μάζας μέσω τριχοειδούς σωλήνα. Επειδή η ροή του αερίου στον τριχοειδή σωλήνα είναι ιξώδης, η ροή σωματιδίων dΝ/dt διέπεται από την υδροδυναμική και δίνεται από την σχέση του Poiseuille:![]() molecules s-1
molecules s-1
όπου
NA ο αριθμός του Avogadro (6.022 x 1023), R η παγκόσμια σταθερά των αερίων (R=8.31 J K-1 mol-1), T η θερμοκρασία, α η διάμετρος του τριχοειδούς, n το ιξώδες του αερίου, l το μήκος του τριχοειδούς, Pα η μέση πίεση 0.5(P1+P0), P1 η πίεση εισόδου και P0 η πίεση εξόδου στο κενό. Το τριχοειδές έχει αρκετά μικρή διάμετρο (0.5 mm) και εκτείνεται σε μήκος περίπου 1 m, συντελώντας στην συνθήκη P1 >> P0. Συνεπώς, το γινόμενο Pα(P1-P0) μπορεί ικανοποιητικά να προσεγγισθεί από την ποσότητα P12, επιτρέποντας τον υπολογισμό της ροής F, dN/dt, με μέτρηση της πίεσης P1:![]()
Η ένταση I του σήματος του φασματογράφου μάζας (για οποιαδήποτε κορυφή) είναι ανάλογη με τον αριθμό ιόντων dN
f που ανιχνεύονται από τον ηλεκτρονοπολλαπλασιαστή σε χρονικό διάστημα dt:![]()
Η ποσότητα d
Nf είναι ανάλογη με τον αριθμό των μητρικών ιόντων dNM που παρήχθησαν στην περιοχή ιονισμού, ενώ ο συντελεστής αναλογίας εξαρτάται από την σταθερότητα του ιόντος, τους πιθανούς δρόμους δημιουργίας και διάσπασης του, ενώ για συγκεκριμένες συνθήκες ενέργειας ιονισμού, δυναμικών εστίασης ιόντων αποτελεί μία σταθερή ποσότητα. Τέλος, ο αριθμός των μητρικών ιόντων dΝΜ εξαρτάται από τον αριθμό των μορίων, τα οποία προσέγγισαν την περιοχή ιονισμού και την πιθανότητα ιονισμού τους. Με συγκεκριμένη γεωμετρία του συστήματος χαμηλού κενού, ο αριθμός των μορίων που προσέγγισαν την περιοχή ιονισμού είναι ανάλογος της συνολικής ποσότητας των ρεόντων μορίων dΝ σε χρονικό διάστημα dt. Συνολικά, η ένταση I μιας κορυφής του φασματογράφου μάζας αναμένεται να είναι ανάλογη της ροής των μορίων F:![]()
Ο συντελεστής αναλογίας
q ορίζει την ευαισθησία ανίχνευσης της χημικής ένωσης και εξαρτάται από τις συνθήκες ιονισμού και διαχωρισμού των ιόντων, από την φύση της χημικής ένωσης, ενώ είναι (προφανώς) διαφορετικός για κάθε κορυφή του φάσματος μάζας της ένωσης. Σταθερά ιόντα ενώσεων που ιονίζονται εύκολα (χαμηλή ενέργεια ιονισμού) έχουν μεγάλες τιμές του παράγοντα q.Ο προσδιορισμός του παράγοντα
q για τις κορυφές σε m/z 94 (μητρική) και 45 (θραύσμα HCº S+) του DMDS, θα γίνει με ταυτόχρονη μέτρηση της πίεσης P1 και των εντάσεων I94 και I45, σε 10 διαφορετικές πιέσεις του μίγματος από 10 έως 20 Torr, με σταδιακή αύξηση της πίεσης του μίγματος DMDS/He στον θάλαμο τροφοδοσίας. Η ροή του DMDS, FDMDS είναι:FDMDS = c Fmix
όπου
c η ποσοστιαία περιεκτικότητα του μίγματος σε DMDS και Fmix η ροή του μίγματος (Fmix = AF P12). Στη συνέχεια κατασκευάζονται τα διαγράμματα των εντάσεων I94 και Ι45 συναρτήσει της ποσότητας PDMDS2.
Αποτελέσματα
Φάσμα μάζας του
CH3SSCH3.
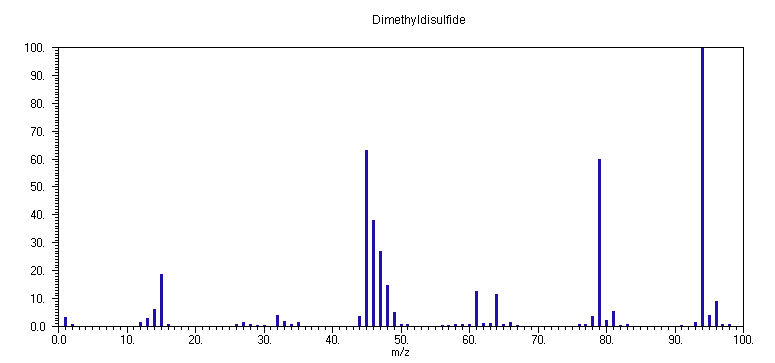
Στο ανωτέρω φάσμα παρατηρούνται οι κύριες κορυφές σε
m/z 94 (μητρική, CH3SSCH3+), 79 (CH3SS+), 64 (S2+), 61 (CH3S+=CH2), 48 (CH3SH+), 47 (CH2=SH+), 46 (CH2=S+), 45 (HCº S+), 32 (S+), 15 (CH3+). Στη φύση, το στοιχείο θείο S βρίσκεται με τη μορφή των ισοτόπων 32S, 33S και 34S, με σχετικές αφθονίες 100, 0.78 και 4.40, αντίστοιχα, και ορισμένες μικρής έντασης κορυφές οφείλονται στο αντίστοιχο ισοτοπομερές (όπως, για παράδειγμα σε m/z 96 το μητρικό κατιόν CH3S34SCH3). Ενα πιθανό σχήμα θραυσματοποίησης του CH3SSCH3 είναι:
Οι δύο ανωτέρω αντιδράσεις μετακίνησης είναι αναγκαίες για την αιτιολόγηση της παρουσίας των θραυσμάτων σε
m/z 48 (CH3SH+) και m/z 61 (CH3S+=CH2) και μπορούν να δικαιολογηθούν με βάση την ικανότητα του ογκώδους ατόμου του S να ανεχθεί έλλειψη ηλεκτρονιακής πυκνότητας καθώς και ασύζευκτη ηλεκτρονιακή πυκνότητα περισσότερο από την ομάδα CH3. Μετά την μετάθεση, τα πιθανά κανάλια διάσπασης είναι η αποβολή των μικρών μορίων CH2=S, και της ομάδας HS, αντίστοιχα:
Επιπλέον, το μητρικό κατιόν μπορεί να διασπαστεί με θραύση των δεσμών
C-S και S-S:Να σημειωθεί ότι το κατιόν
CH3S+ πιθανότατα βρίσκεται με την μορφή του ισομερούς του CH2=SH+ βάσει της θερμοδυναμικά ευνοϊκής μετακίνησης ατόμου Η στο άτομο του S. Το δευτερογενώς σχηματιζόμενο κατιόν CH3SH+ με διαδοχικές αποσπάσεις ατόμων H οδηγεί στην παρουσία των θραυσμάτων CH2=SH+, CH2=S+ και HCº S+:
Τυπικό διάγραμμα βαθμονόμησης των ευαισθησίας στις κορυφές
I94 και Ι45 του DMDS σε ενέργεια ηλεκτρονίων 20 eV.
![]()
Είναι ενδιαφέρον να παρατηρηθεί η πολύ καλή γραμμική εξάρτηση της έντασης των κορυφών του φάσματος μάζας από την ροή της χημικής ένωσης. Η εξαιρετικά καλή γραμμική συμπεριφορά του φασματογράφου μάζας επιτρέπει την χρήση του σε ποσοτικές αναλύσεις συστατικών μίγματος, όπως θα δειχθεί στην επόμενη άσκηση κινητικής μελέτης της χημικής αντίδρασης του
CH3SSCH3 με άτομα Cl, στην αέρια φάση.
Άσκηση 3
ΜΕΛΕΤΗ ΤΟΥ ΜΗΧΑΝΙΣΜΟΥ ΚΑΙ ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΗΣ ΣΤΑΘΕΡΑΣ ΤΑΧΥΤΗΤΑΣ ΧΗΜΙΚΩΝ ΑΝΤΙΔΡΑΣΕΩΝ
ΜΕ ΦΑΣΜΑΤΟΓΡΑΦΙΑ ΜΑΖΑΣ
Η άσκηση σκοπεύει στην διασάφηση του μηχανισμού της χημικής αντίδρασης μεταξύ
CH3SSCH3 και ατόμων Cl, καθώς και στον πειραματικό προσδιορισμό της σταθεράς ταχύτητας της k σε θερμοκρασία δωματίου, 298 K.Ο μηχανισμός των διμοριακών αντιδράσεων ατόμων
Cl με χημικές ενώσεις που περιέχουν άτομα Η συνήθως περιλαμβάνει μόνο την μετάθεση ενός ατόμου υδρογόνου της ένωσης στο άτομο του Cl, και τον σχηματισμό της αντίστοιχης ελεύθερης ρίζας και HCl:k
Υπάρχει μία πληθώρα τεχνικών προσδιορισμού των τελικών προϊόντων αντιδράσεων που επιτελούνται στην αέρια φάση, ενώ συχνότερα χρησιμοποιούνται η φασματογραφία μάζας, η φασματογραφία υπερύθρου και η αέρια χρωματογραφία. Ο προσδιορισμός της σταθεράς ταχύτητας k είναι επίσης δυνατός με την χρήση ποικίλων τεχνικών, εκ των οποίων κάθε μία έχει πλεονεκτήματα και μειονεκτήματα. Οσον αφορά τον τρόπο της ανάλυσης, οι τεχνικές μπορούν περαιτέρω να διακριθούν σ' αυτές που έχουν τη δυνατότητα μέτρησης συγκεντρώσεων αντιδρώντων ή/και προϊόντων συναρτήσει του χρόνου (time-resolved analysis) και σ' αυτές που προσδιορίζουν ένα χρονικά αμετάβλητο μέγεθος, σε σύγκριση με μεγέθη των οποίων η χρονική εξάρτηση είναι εκ των προτέρων γνωστή (π.χ. μέθοδος σχετικών ταχυτήτων, αντιδραστήρας χαμηλής πίεσης). Στην άσκηση θα χρησιμοποιηθεί η μέθοδος του αντιδραστήρα πολύ χαμηλής πίεσης (Very Low Pressure Reactor, VLPR), η οποία μπορεί να υπολογίσει με μεγάλο βαθμό αξιοπιστίας σταθερές ταχύτητας ταχέων διμοριακών αντιδράσεων (k > 1.0 x 10-15 cm3 molecule-1 s-1).
Very Low Pressure Reactor (VLPR)
Πειραματική Διάταξη
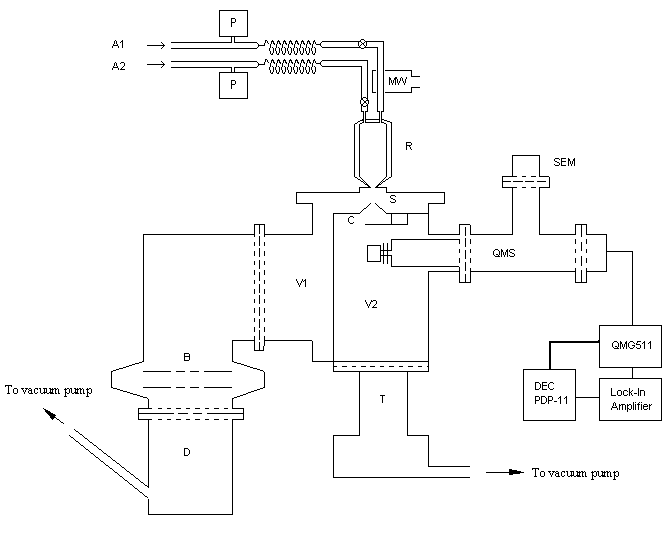
Σύστημα
VLPR: R = αντιδραστήρας, A1,A2 = σωλήνες παροχής αερίων, MW = μικροκυματική εκκένωση, P = πυκνωτικοί μετρητές πίεσης, S = περιοριστής μοριακής δέσμης, C = τεμαχιστής δέσμης (200 Hz), QMS = τετραπολικό φίλτρο μαζών, SEM = ΗλεκτρονοΠολλαπλασιαστής, V1,V2 = Θάλαμοι υψηλού κενού, B = παγίδα, D = Αντλία Διαχύσεως, T = Turbomolecular αντλία κενού.
Περιγραφή του συστήματος
Το σύστημα αποτελείται από ένα κυλινδρικό θερμοστατούμενο αντιδραστήρα, ο οποίος φέρει δύο ή τρείς τριχοειδείς σωλήνες για την παροχή των αερίων αντιδρώντων και συνδέεται μέσω μιάς οπής διαφυγής σε θάλαμο υψηλού κενού (
P < 10-6 mbar). Η δημιουργία των ατόμων Cl γίνεται με συνεχή ακτινοβόληση μίγματος Cl2 σε He με μικροκυματική ακτινοβολία (2450 MHz) σε ισχύ 25-30 W, καθώς το μίγμα ρέει στον αντιδραστήρα δια μέσου ενός σωλήνα από χαλαζία (SiO2). Από την άλλη είσοδο του αντιδραστήρα ρέει το μίγμα DMDS/He. Η ταχεία ανάμιξη των αντιδρώντων οδηγεί σε χημική αντίδραση και το μίγμα εκρέει από την οπή διαφυγής πρός τον θάλαμο υψηλού κενού και αναλύεται από το φασματογράφο μάζας. Επειδή η ολική πίεση στον αντιδραστήρα είναι πολύ χαμηλή (P < 3 mTorr), η κίνηση των μορίων σ' αυτόν περιγράφεται από την κινητική θεωρία των αερίων και ως εκ τούτου, η διαφυγή των μορίων είναι μία διαδικασία, που ακολουθεί κινητική πρώτης τάξεως:d[S]/dt = kesc,S [S] (3.1)
Για οποιοδήποτε συστατικό
S, ισχύει η συνθήκη στάσιμης κατάστασης, η οποία περιγράφεται από την έκφραση:Ροή εισόδου
S στον αντιδραστήρα = Διαφυγή S από τον αντιδραστήρα +Απώλεια του
S λόγω χημικής αντίδρασηςή
ισοδύναμα:Fs / V = kesc,S [S] + k [S][Q] (3.2)
όπου
Fs η ροή εισόδου του S, V o όγκος του αντιδραστήρα, kesc,S η σταθερά πρώτης τάξεως διαφυγής του S, k η σταθερά ταχύτητας της αντίδρασης μεταξύ S και Q, και [S], [Q] οι συγκεντρώσεις των S και Q στον αντιδραστήρα, αντίστοιχα. Στην ανωτέρω σχέση έχει υποτεθεί ότι η μόνη δυνατότητα αντίδρασης του S είναι:k
Είναι φυσικό ότι αν το
S αντιδρά και με κάποιο (ή κάποια) από τα προϊόντα (δευτερογενείς αντιδράσεις), τότε περισσότεροι παράγοντες πρέπει να προστεθούν στο δεύτερο μέλος της σχέσης (3.2).Αν η ροή του Q μηδενιστεί (κλείσιμο της στρόφιγγας παροχής του
Q), τότε ισχύει:Fs / V = kesc,S [S]o (3.3)
και αποκαθίσταται μία νέα στάσιμη κατάσταση, με συγκέντρωση του
S, [S]o (προφανώς, [S]o > [S]). Εξισώνοντας τα δεύτερα μέλη των δύο ανωτέρω σχέσεων:kesc,S [S]o = kesc,S [S] + k [S][Q] Þ
Δ[S] kesc,S = k [S][Q] (3.4)όπου Δ[
S], η μεταβολή της στάσιμης συγκέντρωσης του S, [S]o – [S].Διαίρεση και των δύο μελών της εξίσωσης με την ποσότητα [
S] οδηγεί στην τελική σχέση:(R – 1) kesc,S = k [Q] (3.5)
όπου το
R αντιστοιχεί στην ποσότητα [S]o/[S].Στην προηγούμενη άσκηση της βαθμονόμησης της ευαισθησίας του φασματογράφου μάζας, είχε δειχθεί ότι η ένταση
IS μιάς κορυφής ενός μορίου είναι ανάλογη της ροής του Fs, και η σχέση επεκτείνεται βάσει της (3.3):IS = qS FS = qS V kesc,S [S] (3.6)
Συνεπώς, η ένταση
IS είναι πάντα ανάλογη της στάσιμης συγκέντρωσης του συστατικού S στον αντιδραστήρα και αφ' ενός η ποσότητα [S]o / [S] ισοδυναμεί με την IS,o / IS, ενώ η ποσότητα [Q] μπορεί να μετρηθεί με γνώμονα την βαθμονόμηση της ευαισθησίας του συστατικού Q, στην κορυφή του IQ:IQ = qQ V kesc,Q [Q] (3.7)
Συνοπτικά, το πείραμα μέτρησης της σταθεράς ταχύτητας
k περιλαμβάνει την μέτρηση της εντάσεως ΙS,o (απουσία Q), καθώς και των εντάσεων ΙS και IQ (παρουσία Q), εφ' όσον οι ποσότητες kesc,S, kesc,Q και qQ έχουν προηγουμένως μετρηθεί, και την εφαρμογή της σχέσης (3.5). Για τον περιορισμό των λαθών λόγω πειραματικών σφαλμάτων (εξ' αιτίας κυρίως του ηλεκτρονικού θορύβου του φασματογράφου μάζας), όπως και τον έλεγχο της κινητικής της αντίδρασης S+Q, η μέτρηση των εντάσεων ΙS,o, ΙS και IQ γίνεται για διάφορες τιμές ΙQ, με σκοπό την δημιουργία γραφικής παράστασης (R-1)kesc,S = f([Q]).Η μελέτη του μηχανισμού της αντίδρασης
Cl + CH3SSCH3 θα γίνει με σύγκριση του φάσματος μάζας των προϊόντων (σε πίεση μίγματος DMDS/He στο θάλαμο τροφοδοσίας 20 mTorr), με το αντίστοιχο φάσμα μάζας, απουσία ατομικού Cl. Η ενέργεια των ιονιζόντων ηλεκτρονίων πρέπει να είναι μικρότερη από 20 eV, για την αποφυγή της θραυσματοποίησης του HCl και της ανεπιθύμητης συνεισφοράς του στην ένταση της κορυφής σε m/z 35, που χρησιμοποιείται για την μέτρηση του ατομικού Cl.Η σταθερά ταχύτητας της αντίδρασης
Cl + CH3SSCH3 θα εξαχθεί από την γραφική παράσταση της ποσότητας (R-1)kesc,Cl συναρτήσει της συγκέντρωσης [CH3SSCH3]. Η συγκέντρωση [CH3SSCH3] θα υπολογισθεί με βάση την βαθμονόμηση του DMDS στην μητρική κορυφή του (προηγούμενη άσκηση) και την μέτρηση της έντασης I94. H μέτρηση των εντάσεων του ατομικού Cl θα γίνει σε m/z 35, συνεπώς R = I35,o/I35. Πρακτικά, γιά κάθε τιμή [DMDS] θα γίνει η μέτρηση των εντάσεων I94 και Ι35, και μάλιστα η μέτρηση της έντασης Ι35 θα γίνεται απουσία και παρουσία DMDS (I35,o και I35, αντίστοιχα). Η μεταβολή της συγκέντρωσης [DMDS] θα γίνει σε 5 βήματα, με αντίστοιχη μεταβολή της πίεσης του μίγματος DMDS/He στο θάλαμο τροφοδοσίας (2, 5, 10, 15 και 20 mTorr, αντίστοιχα).Αποτελέσματα
Το φάσμα μάζας των
DMDS, των προϊόντων της μικροκυματικής διάσπασης του Cl2 καθώς και ένα τυπικό φάσμα των προϊόντων της αντίδρασης παρουσιάζονται στην επόμενη σελίδα. Στο φάσμα μάζας της μικροκυματικής διάσπασης του Cl2, παρατηρείται ο σχηματισμός HCl από ανεπιθύμητες αντιδράσεις των ατόμων Cl με το επίστρωμα του σωλήνα χαλαζία (H3BO3/H3PO4) το οποίο υπάρχει για να βοηθήσει στην σχεδόν ποσοτική μετατροπή του Cl2 σε άτομα Cl (μικρά ποσά παραμένοντος Cl2 φαίνονται σε m/z 70, 72 και 74).Αν εξετασθεί το φάσμα μάζας των προϊόντων της αντίδρασης και συγκριθεί με τα δύο προηγούμενα, παρατηρείται η πτώση των κορυφών που οφείλονται στο
DMDS και στο άτομο Cl, και η παραγωγή HCl (σε m/z 36, 38) καθώς και δύο νέες κορυφές σε m/z 72 και 74, οι οποίες αντιστοιχούν στα κατιόντα CH3S35Cl+ και CH3S37Cl+, και πιθανότατα οφείλονται στον σχηματισμό CH3SCl. Συνεπώς, η αντίδραση μεταξύ ατόμων Cl και CH3SSCH3 χωρεί μέσω δύο παραλλήλων δρόμων:

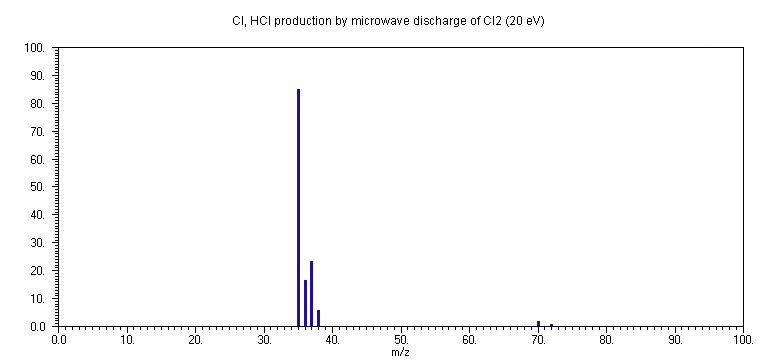

Η σταθερά ταχύτητας
k της αντίδρασης ευρίσκεται από την κλίση του διαγράμματος (R-1)kesc,Cl = k [CH3SSCH3], ένα τυπικό δείγμα του οποίου παρουσιάζεται στη συνέχεια.
![]()
Η μελετηθείσα αντίδραση αποτελεί μία από τις ταχύτερες αντιδράσεις του ατομικού
Cl, με σταθερά ταχύτητας σε θερμοκρασία δωματίου 298 Κ, 2.04 ± 0.02 ´ 10-10 cm3 molecule-1 s-1. To DMDS έχει ανιχνευθεί στον θαλάσσιο ατμοσφαιρικό αέρα και η ταχύτατη αντίδραση του με τα άτομα Cl πιθανά συνεισφέρει στην τροποσφαιρική του αποικοδόμηση στο θαλάσσιο περιβάλλον, όπου η συγκέντρωση των ατόμων Cl υπολογίζεται ότι είναι της τάξεως των 104 atoms cm-3.
Βιβλιογραφία – Αναφορές
World Wide Web
http://webbook.nist.gov
Φάσματα μάζας ανόργανων και οργανικών ενώσεωνhttp://www.scimedia.com/chem-ed/ms Φασματογραφία μάζας
http://masspec.scripps.edu Φασματογραφία μάζας / Ιστορία της Φασμ. Μάζας
http://www.chem.arizona.edu/massspec/contents.html
http://www.jeol.com/ms
Αναλυτική περιγραφή της Φασματογραφίας ΜάζαςΠηγές Ιονισμού, Φίλτρα Μαζών, Ανιχνευτές Ιόντων
από την εταιρεία
JEOLhttp://www.sisweb.com
Εταιρεία Scientific Instruments Services
http://www.altavista.com
Μηχανή Αναζήτησης.(Μεγάλο πλήθος ιστοσελίδων σε "
Mass Spectrometry").
Βιβλία
– Κατάλογοι Φασμάτων